Mangaanioksidi (MnO2) Kemiallinen rakenne, ominaisuudet ja käyttötavat
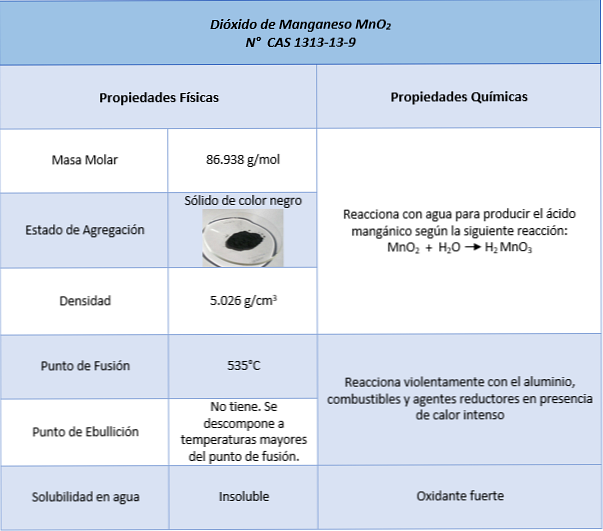
mangaanioksidi (MnO2) on epäorgaaninen kemiallinen yhdiste, joka muodostuu mangaanielementistä, jossa on hapetusnumero +4 ja happi, jonka oksidien muodostuksessa hapettumisnumero on -2. Se tunnetaan myös mangaani- (IV) oksidin ja mangaanianhydridin nimillä.
Se on kiinteä pimeästä mustaan kahviin. Se on luonteeltaan mineraalinen pirolusiitti, musta ja kiteytynyt muodostava dendriitti (haarautuneita venymiä). Se voidaan saada mustana jäännöksenä reaktiossa etyleenin ja kaliumpermanganaatin välillä glykolin muodostumisen jälkeen kaliumpermanganaatin hapettavalla vaikutuksella.

Se on erittäin tärkeää lasiteollisuudessa hapettimen luonteen takia, koska se poistaa rautapitoisista yhdisteistä peräisin olevan vihreän värin ja muuntaa ne rautametalliksi..
indeksi
- 1 Kemiallinen rakenne
- 2 Ominaisuudet
- 3 Käyttö
- 3.1 Katalysaattorina
- 4 Vaikutukset terveyteen
- 5 Viitteet
Kemiallinen rakenne
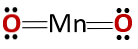
Yhdisteen kemiallinen rakenne vastaa anhydridin eikä emäksisen oksidin rakennetta, kuten odotettaisiin, koska se koostuu metallista ja ei-metallista.
Tämä erityistapaus johtuu mangaanin käyttäytymisestä eri hapettumisolosuhteissa. Täten hapettumisolosuhteet +2 ja +3 muodostavat oksidit MnO ja Mn2O3 vastaavasti, että kun ne reagoivat veden kanssa, ne muodostavat mangaanihydroksidin ja mangaanihydroksidin.
Mn2O3 hieman happamassa väliaineessa se toimii anhydridinä. Kun hapettumisolosuhteet ovat +4, +6 ja +7, MnO2, MnO3 ja MnO4 ne muodostavat happoja reagoimalla veden kanssa.
Hieman happamassa väliaineessa MnO2 se toimii kuin perusoksidi, joten se voisi muodostaa vastaavan hydroksidin.

On pidettävä mielessä, että tässä tapauksessa ei mainita amfoteerisia ominaisuuksia, joiden mukaan yhdiste voi käyttäytyä happona tai emäksenä. Tämä on erityinen Mn-käyttäytymisen tapaus.
ominaisuudet
sovellukset
- Sitä käytetään mangaanilähteenä
- Hapettimena alkaliparistoissa
- Lasit, keramiikka ja posliini.
- Kloorin ja jodin saamiseksi.
- Vetyperoksidin hajoamisessa kaasumaisen hapen ja veden muodostamiseksi.
- Kaliumkloraatin hajoamisreaktiossa kaasumaisen hapen ja kaliumkloridin tuottamiseksi.
- Liuotettu asetoniin tai dikloorimetaaniin, hapettaa primaarialkoholeja aldehydeiksi ja sekundaarisesti ketoneiksi.
- Alkaliparistojen valmistus.
Katalysaattorina
Tämä koskee oksidien pelkistysreaktioita, sulfidien kuten H: n poistamiseksi2S ja kationit kuten Fe+2 ja Mn+2 , pohjavedessä esiintyvä arseeni ja radio, jotka ovat tämän tyyppisten yhdisteiden saastuttamia.
Tämä kontaminaatio voi syntyä myrkyllisten aineiden hallitsemattomalla polkumyynnillä, pesemällä saastunutta maata tai kemiallisten elementtien läsnä ollessa vedenpoiston aikana..
MnO2 Suodattimena käytetystä pyrolusiitista saatu suuri puhtaus (Filox) on tehokkain keino poistaa tämä luokan epäpuhtauksia pohjavedestä.
Vaikutukset terveyteen
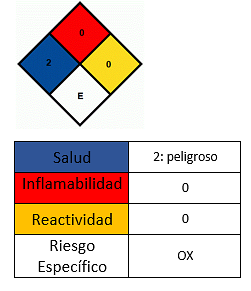
- Vältä kosketusta ihoon.
- Jos kosketat, pese vastaava alue.
- Älä hengitä jauheita.
- Silmäkosketuksessa voi nähdä ärsytystä ja punoitusta. Pese runsaalla vedellä, anna veden kulkea silmien läpi ja pyytää lääkärin apua vakavien tapausten varalta.
- Ihokosketuksessa havaitaan ärsytystä ja punoitusta. Pese ihoalue runsaalla vedellä ja saippualla.
- Pitkäaikainen ihokosketus poistaa luonnollisen rasvan ja laukaisee ihotulehduksen.
- Hengitys voi aiheuttaa flunssan kaltaisen tilan (metallihöyryt). Taudille on ominaista korkea kuume, vilunväristykset, suun kuivuminen ja kurkku, lihaskipu ja päänsärky.
- Se voi ärsyttää hengitysteitä ja lisätä hengitystieinfektioiden (keuhkokuume) esiintyvyyttä. Myrkytys, kun imeytyy epäorgaanisia mangaanisuoloja keuhkojen läpi, on epätodennäköistä, mutta krooninen myrkytys voi tapahtua.
- Pitkäaikainen altistuminen mangaanidioksidin pölylle tai höyryille voi vaikuttaa keskushermostoon ja johtaa Parkinsonin taudin, kävelyvaikeuksien, lihaskouristusten ja käyttäytymismuutosten kehittymiseen..
- Nieleminen voi aiheuttaa vatsakipua ja pahoinvointia.
- Se ei ole syttyvää, mutta se auttaa levittämään tulipalon hehkuviin materiaaleihin. Jos se kuumennetaan yli 535 ° C: n lämpötilaan, aine hajoaa mangaanioksidiksi (III) Mn2O3 ja happea, joka on syttyvää ja lisää tulipalon vaaraa. Tällöin tulipalo tulisi sammuttaa vaahdolla tai hiilidioksidilla.
- Jos vuoto tapahtuu, älä käsittele yhdistettä ilman asianmukaista henkilökohtaista suojausta.
- Säilytä yhdistettä tiiviisti suljetuissa astioissa kylmässä ja kuivassa paikassa ja poissa yhteensopimattomista aineista, kuten orgaanisesta materiaalista ja palavasta materiaalista.
- Säilytyspaikan on oltava kuiva ja siinä on lattiat, jotka kestävät hapon korroosiota ja hyvät viemärit..
- Henkilökohtaisia suojavarusteita on käytettävä, kuten käsineitä, suojalaseja, höyrynestosuodattimia, pölyä ja savua.
viittaukset
- B, (2015), mangaanidioksidi, Royal Society of Chemistry - Chemistry world, joka on haettu kemiallisesta verkosta.
- Karal, (2014), Mangneso-dioksidi, Käyttöturvallisuustiedote, Palautettu, karal.com.mx
- Virtuaaliopettajasi (25.2.2015). Mangaanin epäorgaaniset yhdisteet (erityistapaus 1) - teoreettinen oppitunti, haettu osoitteesta youtube.com
- Ecured, (s.f), mangaanidioksidi, talteen otettu ecured.cu
- Angarita G, Johnny., (2017), mangaanidioksidi: poikkeuksellinen tekniikka. Hidroteco, palautettu osoitteesta hydrotecocr.com
- Fernández, G., (2015), MnO-mangaanidioksidi2/ asetoni, Orgaaninen kemia, Palautettu osoitteesta quimicaorganica.net
- Tronox, (2011), mangaanidioksidi, käyttöturvallisuustiedote, palautettu, tronox.com


