Hopeasulfidirakenne (Ag2S), ominaisuudet, nimikkeistö, käyttö
hopeasulfidi on epäorgaaninen yhdiste, jonka kemiallinen kaava on Ag2S. Se koostuu Ag-kationien muodostamasta mustanharmaasta kiinteästä aineesta+ ja anionit S2- suhteessa 2: 1. S2- se on hyvin samanlainen kuin Ag+, koska molemmat ovat pehmeitä ioneja ja ne onnistuvat vakautumaan keskenään.
Hopeakoristeet pyrkivät tummentumaan ja menettävät luonteensa. Värinmuutos ei ole hopean hapettumisen tuote, vaan sen reaktio ympäristössä esiintyvän vetysulfidin kanssa pieninä pitoisuuksina; Tämä voi johtua kasvien, eläinten tai rikkiä sisältävien elintarvikkeiden rappeutumisesta tai hajoamisesta.

H2S, jonka molekyylissä on rikkiatomi, reagoi hopean kanssa seuraavan kemiallisen yhtälön mukaisesti: 2Ag (s) + H2S (g) => Ag2S (s) + H2(G)
Siksi Ag2S vastaa hopean päälle muodostuneista mustista kerroksista. Luonnossa tämä rikki löytyy kuitenkin myös acantita- ja argentita-mineraaleista. Kaksi mineraalia erottuvat monista muista mustista ja kirkkaista kiteistä, kuten ylemmässä kuvassa olevasta kiinteästä aineesta.
Ag2S esittää polymorfisia rakenteita, houkuttelevia elektronisia ja optoelektronisia ominaisuuksia, on puolijohde ja lupaa olla materiaali aurinkokennojen, kuten aurinkokennojen, kehittämiseen.
indeksi
- 1 Rakenne
- 2 Ominaisuudet
- 2.1 Molekyylipaino
- 2.2 Ulkonäkö
- 2.3 Haju
- 2.4 Sulamispiste
- 2.5 Liukoisuus
- 2.6 Rakenne
- 2.7 Taitekerroin
- 2.8 Dielektrinen vakio
- 2.9 Elektroniikka
- 2.10 Pelkistysreaktio
- 3 Nimikkeistö
- 3.1 Järjestelmät
- 3.2 Varasto
- 3.3 Perinteinen
- 4 Käyttö
- 5 Viitteet
rakenne
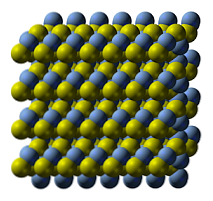
Hopean sulfidin kiteinen rakenne on esitetty ylemmässä kuvassa. Siniset pallot vastaavat Ag-kationeja+, kun taas keltaiset anionit S2-. Ag2S on polymorfinen, mikä tarkoittaa, että se voi ottaa käyttöön useita kiteisiä järjestelmiä tietyissä lämpötilan olosuhteissa.
Miten? Vaihesiirron kautta. Ionit järjestetään uudelleen siten, että lämpötilan nousu ja kiinteän aineen värähtelyt eivät häiritse sähköstaattisen vetovoiman ja tukahduttamisen tasapainoa. Kun näin tapahtuu, sanotaan, että on vaihesiirto, ja siksi kiinteällä aineella on uusia fysikaalisia ominaisuuksia (kuten kiiltoa ja väriä)..
Ag2S normaaleissa lämpötiloissa (alle 179 ° C) on monokliininen kiteinen rakenne (a- Ag2S). Tämän lisäksi kiinteä faasi on kaksi muuta: bcc (kehon kuutiollinen) välillä 179 ja 586ºC, ja FCC (kuutiohilarakenne keskitetty) erittäin korkeissa lämpötiloissa (Ag δ-2S).
Argentiittimineraali koostuu fcc-faasista, joka tunnetaan myös nimellä P-Ag2S. Kun jäähdytetty ja muunnettu kallioksi, niiden rakenneominaisuudet vallitsevat yhdessä. Siksi molemmat kiderakenteet ovat rinnakkain: monokliininen ja bcc. Niinpä syntyy mustia kiintoaineita, joissa on kirkkaita ja mielenkiintoisia merkkejä.
ominaisuudet
Molekyylipaino
247,80 g / mol
ulkomuoto
Harmaat mustat kiteet
haju
wC.
Sulamispiste
836ºC. Tämä arvo on samaa mieltä siitä, että Ag2S on yhdiste, jolla on vähän ionista merkkiä ja siten sulaa lämpötiloissa, jotka ovat alle 1000 ° C.
liukoisuus
Vedessä vain 6,21 ∙ 10-15 g / l 25 ° C: ssa. Toisin sanoen liuotettavan mustan kiinteän aineen määrä on vähäinen. Tämä johtuu jälleen Ag-S-sidoksen vähäisestä polaarisesta luonteesta, jossa ei ole merkittävää eroa elektroniikan välillä molempien atomien välillä.
Myös Ag2S ei liukene kaikkiin liuottimiin. Mikään molekyyli ei voi erottaa tehokkaasti kiteisiä kerroksia Ag-ioneissa+ ja S2- solvatoitua.
rakenne
Neljä S-Ag-S-sidosten kerrosta voidaan nähdä myös rakenteen kuvassa, joka liikkuu toistensa yli, kun kiinteä aine on ymmärretty. Tämä käyttäytyminen tarkoittaa sitä, että huolimatta siitä, että se on puolijohde, se on sitkeä kuin monet metallit huoneenlämpötilassa.
S-Ag-S-kerrokset sopivat oikein, koska niiden kulma-geometriaa pidetään siksakina. Kun heillä on ymmärryksen voima, ne liikkuvat siirtymäakselilla, mikä aiheuttaa uusia ei-kovalenttisia vuorovaikutuksia hopean ja rikin atomien välillä.
Taitekerroin
2.2
Dielektrinen vakio
6
elektroninen
Ag2S on amfoteerinen puolijohde, eli se käyttäytyy sellaisena kuin se olisi tyyppiä n ja tyyppiä p. Se ei myöskään ole hauras, joten sitä on tutkittu sen soveltamiseksi elektronisiin laitteisiin.
Pelkistysreaktio
Ag2S voidaan pelkistää metalliseksi hopeaksi uimalla mustat palat kuumalla vedellä, NaOH: lla, alumiinilla ja suolalla. Seuraava reaktio tapahtuu:
3AG2S (s) + 2Al (s) + 3H2O (l) => 6Ag (s) + 3H2S (ac) + Al2O3(S)
nimistö
Hopea, jonka elektroninen kokoonpano on [Kr] 4d105S1, se voi menettää vain yhden elektronin: sen uloimpien kiertoradan 5s. Niinpä Ag+ pysyy elektronisessa kokoonpanossa [Kr] 4d10. Siksi sillä on ainutlaatuinen +1-valenssi, joka määrittää, miten sen yhdisteet tulisi kutsua.
Rikki on toisaalta elektroninen kokoonpano [Ne] 3s23p4, ja se tarvitsee kaksi elektronia valenssi-oktetin suorittamiseksi. Kun se saa nämä kaksi elektronia (hopeasta), se muuttuu rikki-anioniksi, S2-, asetuksella [Ar]. Toisin sanoen se on isoelektroninen argonjalokaasuun.
Niin että Ag2S on kutsuttava seuraavien nimikkeistöjen mukaisesti:
systematiikka
apinasulfidi dihopea. Tässä tarkastellaan kunkin elementin atomien lukumäärää ja ne on merkitty kreikkalaisten lukijoiden etuliitteillä.
kalusto
Hopeasulfidi. Kun käytössä on ainutlaatuinen +1 -valenssi, sitä ei ole määritetty roomalaisilla numeroilla suluissa: hopea-sulfidi (I); mikä on virheellinen.
perinteinen
Sulphuro argéntICO. Koska hopea "toimii" +1: n valenssilla, suffiksi -ico lisätään sen nimeen Argentum latinaksi.
sovellukset
Ag: n uudet käyttötarkoitukset2S ovat seuraavat:
-Niiden nanopartikkeleiden (eri kokoisilla) ratkaisut, jotka ovat antibakteerisia, eivät ole myrkyllisiä, ja siksi niitä voidaan käyttää lääketieteen ja biologian aloilla..
-Niiden nanohiukkaset voivat muodostaa kvanttipisteitä. Nämä absorboivat ja säteilevät suurempaa intensiteettiä kuin monet orgaaniset fluoresoivat molekyylit, joten ne voivat korvata jälkimmäiset biologisiksi markkereiksi.
-A-Ag: n rakenteet2S tekee siitä näyttäviä sähköisiä ominaisuuksia, joita voidaan käyttää aurinkokennoina. Se on myös lähtökohta uusien termoelektristen materiaalien ja anturien synteesille.
viittaukset
- Mark Peplow. (17. huhtikuuta 2018). Puolijohdesarjan sulfidi ulottuu metalliin. Otettu: cen.acs.org
- Yhteistyö: Tekijät ja toimittajat volyymit III / 17E-17F-41C () hopea sulfidi (Ag 2S) kiderakenne. In: O. Madelung, U. Rössler, Schulz M. (toim) Ei-tetraedrisesti Bonded elementit ja Binary yhdisteet I. Landolt-Bornstein - Condensed Matter ryhmä III (numeerisesta datasta ja toiminnalliset suhteet tieteen ja teknologian), voi 41C. Springer, Berliini, Heidelberg.
- Wikipedia. (2018). Hopeasulfidi. Otettu: en.wikipedia.org
- Stanislav I. Sadovnikov & col. (Heinäkuu 2016). Ag2S-hopea-sulfidi-nanohiukkaset ja kolloidiset liuokset: Synteesi ja ominaisuudet. Otettu: sciencedirect.com
- Azo-materiaalit. (2018). Hopea-sulfidi (Ag2S) Puolijohteet. Otettu osoitteesta azom.com
- A. Nwofe. (2015). Hopean sulfidikalvojen näkymät ja haasteet: Katsaus. Materiaalitieteen ja uusiutuvan energian osasto, teollisen fysiikan laitos, Ebonyi State University, Abakaliki, Nigeria.
- UMassAmherst. (2011). Luentojen esittelyt: puhdistus tuhoutunut hopea. Otettu: lecturedemos.chem.umass.edu
- Tutkimus. (2018). Mikä on Silver Sulfide? - Kemiallinen kaava ja käyttö. Otettu: study.com


