Rautasulfidi (II) Ominaisuudet, riskit ja käyttötavat
rautasulfidi (II), kutsutaan myös ferrosulfidiksi, on kemiallinen yhdiste, jolla on kaava FeS. Rautasulfidijauhe on pyroforinen (se syttyy itsestään ilmassa).
Sulfidirauta (II) saadaan kuumentamalla rikkiä ja rautaa reaktion mukaan:
Fe + S → FeS
Reaktio on hyvin eksoterminen (vapauttaa lämpöä) ja raudan ja rikin välinen suhde on 7: 4 (NileRed, 2014).
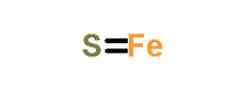
Ferrosulfidia voidaan saada myös vesipitoisessa väliaineessa liuottamalla rikki ioniseen rauta (II) -liuokseen. Rikki, kun se on liuennut, muodostaa vetysulfidia, joka reagoi reversiibelisti rauta (II) -ionien kanssa reaktion mukaan
usko2+ + H2S FeS (s) + 2H+
Tämä reaktio kilpailee kuitenkin raudan (II) happosulfaatin muodostumisreaktion kanssa seuraavalla tavalla:
usko2+ + 2HS- → Fe (HS)2(S)
Sitten rauta (II) happosulfaatti hajoaa rauta-sulfaatiksi, vaikka reaktio tapahtuu hyvin hitaasti (Rickard, 1995).
indeksi
- 1 Fysikaaliset ja kemialliset ominaisuudet
- 2 Reaktiivisuus ja vaarat
- 3 Käsittely ja varastointi
- 4 Käyttö
- 5 Viitteet
Fysikaaliset ja kemialliset ominaisuudet
Rauta (II) sulfidi on tummanruskea tai musta metallinen näköinen kiinteä aine. Kun se on puhdasta, se on väritöntä (National Center for Biotechnology Information, S.F.). Kuvio 2 havainnollistaa ferrosulfidin ulkonäköä.

Yhdisteen molekyylipaino on 87,910 g / mol ja tiheys 4,84 g / ml. Sen sulamispiste on 1195 ° C ja se ei liukene veteen ja typpihappoon (Royal Society of Chemistry, 2015).
Rautasulfidi reagoi happamassa väliaineessa muodostamaan rautaoksidia ja rikkivetyhöyryjä, jotka ovat erittäin myrkyllisiä. Tämä havaitaan seuraavassa reaktiossa:
FeS + 2H+ → Usko2+ + H2S
Reagoi laimennetun rikkihapon liuoksen kanssa muodostaen rautaoksidia, rikkidioksidia ja vettä reaktion mukaan:
FeS + H2SW4 → FeO + H2O + SO2
Reaktiivisuus ja vaarat
Ferrosulfidi on epästabiili yhdiste ja reagoi ilman kanssa muodostaen rautaoksidia ja rikkiä. Yhdiste on pyroforinen ja voi syttyä spontaanisti tai myös voimakkaasti vaikuttavan tuotteen, joten se ei ole suositeltavaa jauhaa laastiin, kun se syntetisoidaan ja sitä on käsiteltävä huolellisesti.
Reagoi hapettimien kanssa ja kuumennetussa hajoamisessa syntyy rikkioksidien myrkyllisiä höyryjä. Yhdiste on erittäin vaarallinen nieltynä ja vaarallisena joutuessaan kosketuksiin silmien kanssa (ärsyttävä) ja hengitettynä (Materiaaliturvallisuustiedote Ferrous sulfide, 2013).
Silmiin joutuessaan ne on huuhdeltava runsaalla vedellä vähintään 15 minuutin ajan, joskus nostettava ylä- ja alahuulia..
Jos yhdiste joutuu kosketuksiin ihon kanssa, se on huuhdeltava runsaalla vedellä vähintään 15 minuutin ajan, samalla kun poistetaan saastuneet vaatteet ja kengät..
Nielemisen yhteydessä, jos uhri on tietoinen ja varovainen, hänelle on annettava 2-4 kupillista maitoa tai vettä. Älä koskaan anna mitään suun kautta tajuttomalle henkilölle
Hengittämisen yhteydessä uhri on poistettava altistumispaikasta ja siirrettävä viileään paikkaan. Jos se ei hengitä, keinotekoinen hengitys on annettava. Jos hengitys on vaikeaa, on annettava happea.
Kaikissa tapauksissa on saatava välitöntä lääketieteellistä apua (kalastus tieteellinen, 2009).
Rautasulfidi on mukana harvinaisessa hyvänlaatuisessa tilassa, joka tunnetaan nimellä pseudomelanosis duodeni. Tämä ilmenee endoskooppisesti erillisinä, tasaisina, mustina ruskeina täplinä pohjukaissuolen limakalvossa.
Se ei tuota oireita ja voi olla palautuva. Elektronimikroskopialla ja elektroni-koettimella tapahtuvan energian dispersion röntgendianalyysillä pigmentti vastaa pääasiassa ferrosulfidin (FeS) kerääntymistä makrofageihin lamina proprian sisällä (Cheng CL, 2000).
Käsittely ja varastointi
Rautasulfidia on pidettävä erillään lämmöstä ja sytytyslähteistä. Tyhjät säiliöt muodostavat palovaaran, jätteet on haihdutettava liesituulettimen alla. Maadoita kaikki materiaalit sisältävät laitteet sähköisten kipinöiden välttämiseksi.
Älä hengitä pölyä. Vältä kosketusta silmiin. Käytä sopivaa suojavaatetusta. Jos ilmanvaihto on riittämätön, käytä sopivaa hengityssuojainta.
Jos et tunne oloasi hyvin, sinun tulee hakeutua lääkärin hoitoon ja näyttää tuotteen etiketti mahdollisimman paljon. Yhdiste on pidettävä erillään yhteensopimattomista aineista, kuten hapettavista aineista ja hapoista.
Yhdistettä sisältävä säiliö tulisi pitää kuivana viileässä paikassa. Ja se on suljettava ilmatiiviisti ilmastoidussa paikassa. Palavat materiaalit tulee säilyttää poissa äärimmäisestä lämmöstä ja pois voimakkaista hapettimista.
sovellukset
Rautasulfidia käytetään lejeeringissä ja ruostumattomasta teräksestä valmistetuissa teollisuudenaloissa vedyn haurastumisen hallitsemiseksi. Rauta- ja terästeollisuus käyttää rautasulfidia uudelleenkylläyttävänä aineena hiili-, seos- ja ruostumattomasta teräksestä valmistettujen terästen valmistuksessa.
Se toimii myös alentavana aineena teräsvalukoneen kapasiteetin parantamiseksi, jota käytetään eri teräsosien valmistuksessa. Raakafosforihapon puhdistuksessa käytetään rautasulfidia pelkistävänä aineena raskaiden epäpuhtauksien poistamiseksi fosforihaposta.
Toinen rautasulfidin käyttö on muovattavan raudan valmistuksessa. Rautasulfidia yhdistettynä rautapiiniin ja ferromangaaniin käytetään teräksen ja raudan rikkipitoisuuden lisäämiseen.
Rautasulfidia käytetään myös laboratoriokemikaalina vetysulfidikaasun valmistuksessa. Hiusten väriaineissa, maaleissa, keramiikassa, pulloissa ja lasissa käytetään rautasulfidia pigmenttinä. Sitä käytetään myös voiteluaineissa ja pakokaasujen käsittelyssä.
Rautasulfidilla on yhteensopiva käyttö sulfaattien kanssa. Sulfaattiyhdisteet ovat vesiliukoisia ja niitä käytetään veden käsittelyssä. Rautasulfidia käytetään myös metallivalujen valmistuksessa.
Rautasulfidi on mineraalipyriitti, joka muistuttaa kultaa ja jota kutsutaan "tyhmän kullaksi". Pyriittiä käytetään rikin ja rikkihapon valmistuksessa ja sitä käytetään myös hiilikaivoksessa (JAINSON LABS (INDIA), S.F.).
viittaukset
- Cheng CL, e. a. (2000). Pseudomelanosis duodeni: tapausraportti. Changgeng Yi Xue Za Zhi 23 (6), 372 - 376.
- tieteellinen kalastaja (2009, elokuu 20). Materiaaliturvallisuustiedote Rauta (II) sulfidi. Haettu lasekasta.
- JAINSON LABS (INDIA). (S.F.). Rautasulfidin käyttö. Haettu jainsonfesista.
- Materiaaliturvallisuustiedote Ferrosulfidi. (2013, 21. toukokuuta). Haettu sciencelabista.
- Kansallinen bioteknologian tiedotuskeskus. (S.F.). PubChem-yhdistelmätietokanta; CID = 14828. Haettu PubChemistä.
- (2014, 15. toukokuuta). Rautan (II) sulfidin valmistus (viileä reaktio). Haettu YouTubesta.
- Rickard, D. (1995). FeS-saostumisen kinetiikka: Osa 1. Kilpailevat reaktiomekanismit. Geochimica et Cosmochimica Acta Volume 59, Issue 21, 4367-4379.
- Royal Society of Chemistry. (2015). Rauta (II) sulfidi. Haettu chemspideristä: chemspider.com.


