Natriumsulfidikaavat, käyttötavat, riskit
natriumsulfidi (Na2S) on kiteinen kiinteä aine keltaisesta tiilenpunaiseksi. Luonnossa sitä esiintyy erilaisina hydratoitumisasteina, ja se on tavallisimmin natriumsulfidi-nonahydraatti (Na2S · 9H2O).
Ne ovat vesiliukoisia suoloja, jotka antavat voimakkaasti emäksisiä liuoksia. Kun ne altistuvat kostealle ilmalle, ne imevät kosteutta ilmassa, joka voi itsestään lämmetä ja aiheuttaa syttymisen lähelle palavia materiaaleja. Samoin kosteuden kanssa kosketuksissa he emittoivat rikkivetyä, joka haisee märehtyneitä munia.

Ne ovat voimakkaita pelkistäviä aineita. Nämä aineet voivat olla vaarallisia ympäristölle, erityisesti vesieliöille.
Natriummonosulfidi on kaupallisesti saatavana hiutaleina, jotka sisältävät 60 - 62% Na: ta2S ...
- kaavat

- CAS: 1313-82-2 natriumsulfidi (vedetön)
- CAS: 1313-84-4 natriumsulfidi (ei-hydratoitu)
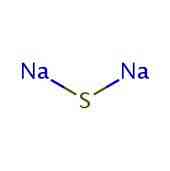
2D-rakenne
3D-rakenne
Natriumsulfidin ominaisuudet
Fysikaaliset ja kemialliset ominaisuudet

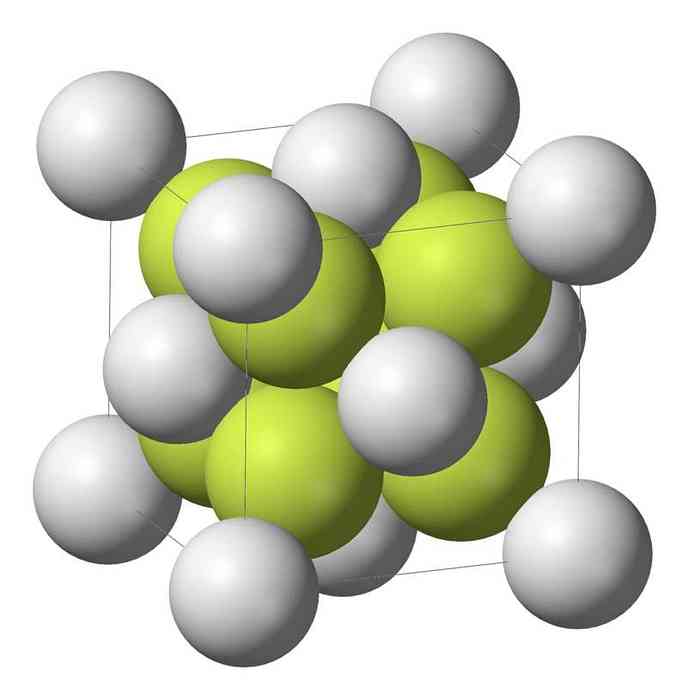
Natriummonosulfidi (Na2S) kiteytyy antifluoriittirakenteella, jossa kutakin S-atomia ympäröi 8 Na-atomin kuutiot ja jokainen Na-atomi neljän atomin tetraedrillä..
syttyvyyttä
Ainoa helposti syttyvä jäsen epäorgaanisten sulfidien ryhmässä on vety- sulfidi. Jotkut muut epäorgaaniset sulfidit, kuten natriumsulfidi, voivat kuitenkin lämmetä itsestään ja jopa syttyä, jos ne altistuvat kosteudelle..
Palossa altistettaessa natriumsulfidi antaa rikkidioksidin kaasuja tai höyryjä, jotka ovat ärsyttäviä tai myrkyllisiä.
reaktiivisuus
- Epäorgaaniset sulfidit ovat yleensä emäksisiä (jotkut ovat voimakkaasti emäksisiä ja siksi yhteensopimattomia happojen kanssa).
- Monet näistä yhdisteistä ovat pelkistäviä aineita (ne reagoivat voimakkaasti hapettavien aineiden kanssa).
- Sulfidien yksinkertaiset suolat (kuten natrium, kalium ja ammoniumsulfidi) reagoivat voimakkaasti happojen kanssa vapauttamaan erittäin myrkyllisiä ja syttyviä rikkivetykaasuja.
- Natriumsulfidi on syttyvää. Voi räjähtää kuumennettaessa nopeasti tai osumatta.
- Kuumentuessaan hajoamiseen se säteilee natriumoksidin ja rikkidioksidien myrkyllisiä höyryjä.
- Reagoi kiivaasti hiilen kanssa hiilellä, diatsoniumsuoloilla, N, N-dikloorimetyyliamiinilla, voimakkailla hapettimilla ja vedellä.
myrkyllisyys
Monet epäorgaanisten sulfidiryhmän jäsenet käyttäytyvät voimakkaina emäksinä ja voivat aiheuttaa vakavia palovammoja, kun ne joutuvat kosketuksiin ihon kanssa.
Tämä ominaisuus riippuu sen liukoisuudesta. Liukenemattomat epäorgaaniset sulfidit (esimerkiksi elohopean (II) sulfidi ja kadmiumsulfidi) eivät ole syövyttäviä.
Natriumsulfidilla on oktanoli / vesi-jakaantumiskerroin (Pow) -väliaine (-3,5). Tätä arvoa käytetään aineen liukoisuuden (ja biokonsentraation) mittaamiseen eläinrasvoissa (erityisesti vesieläimissä)..
Natriumsulfidia pidetään ympäristölle vaarallisena, erityisesti vesieliöille.
sovellukset
Kotona natriumsulfidia käytetään putkien paljastamiseen, kotitalouksien puhdistusaineisiin (uuniin, kylpyhuoneeseen), hiusten tasoittimiin, astian saippualle ja automaattisiin turvatyynyihin.
Teollisuudessa sitä käytetään puhdistusaineissa, sementissä ja muiden kemiallisten tuotteiden valmistuksessa.
Kliiniset vaikutukset
Natriumsulfidin altistuminen on yleistä kehittyneissä maissa ja heikosti kehittyneissä maissa sekä teollisuudessa että kotona. Nämä syövyttävät aineet ovat läsnä useissa kotitaloustuotteissa alhaisessa pitoisuudessa.
Kehittyneissä maissa vakavat vaikutukset ovat harvinaisia. Ne johtuvat pääasiassa kemikaalin tahallisesta nauttimisesta aikuisilla. Kehitysmaissa vakavat vaikutukset ovat kuitenkin yleisempiä.
Alkaliset syövyttävät aineet aiheuttavat nesteytyksestä johtuvaa nekroosia. Saponifioi solukalvon rasvat, tuhoaa solun ja mahdollistaa syvän tunkeutumisen limakalvojen kudokseen.
Suullinen altistuminen
Alkuperäinen tulehdus esiintyy ruoansulatuskanavassa, jota seuraa kudoksen nekroosi (mahdollinen rei'itys), sitten granulointi ja lopulta stenoosin muodostuminen.
Potilailla, joilla on lievä nieleminen, esiintyy orofarynxin, ruokatorven tai vatsan ärsytystä tai I-luokan palovammoja (pinnallinen hyperemia ja ödeema)..
Keskivaikeaa myrkytystä sairastavat potilaat voivat kehittää toisen asteen palovammoja (pinnallisia rakkuloita, eroosioita ja haavaumia), joilla voi olla edelleen stenoosia (erityisesti ruokatorven)..
Joillakin potilailla (erityisesti pienillä lapsilla) voi esiintyä turvotusta ylemmissä hengitysteissä.
Potilaat, joilla on voimakas myrkytys nielemällä, voivat kehittää syviä palovammoja ja gastrointestinaalisen limakalvon nekroosia, jolloin komplikaatioita ovat esimerkiksi: rei'itys (ruokatorven, mahalaukun, harvoin pohjukaissuoli), fistulan muodostuminen (tracheoesophageal, aortoesophageal) ja ruoansulatuskanavan verenvuoto.
Ne voivat kehittyä: hypotensio, takykardia, takypnea, tiukentumisen muodostuminen (pääasiassa ruokatorvi), ruokatorven karsinooma ja ylempien hengitysteiden turvotus (joka on yleinen ja usein hengenvaarallinen).
Vakava myrkytys rajoittuu yleensä aikuisten tahallisiin saantiin.
Altistuminen hengitettynä
Lievä altistuminen voi aiheuttaa yskää ja keuhkoputkia.
Vaikea hengitettynä voi aiheuttaa ylempien hengitysteiden turvotusta, palovammoja, stridoria ja harvoin akuuttia keuhkovaurioita.
Silmäaltistus
Se voi aiheuttaa vaikeaa sidekalvon ärsytystä ja kemoosia, sarveiskalvon epiteelivikoja, limbistä iskemiaa, pysyvää näönhukkaa ja vakavissa perforaatiotapauksissa..
Ihoaltistuminen
Lievä altistus aiheuttaa ärsytystä ja osittaista paksuutta. Metabolinen asidoosi voi kehittyä potilailla, joilla on vakavia palovammoja tai sokki.
Pitkäaikainen altistuminen tai korkeat pitoisuudet saattavat aiheuttaa kokonaispaksuutta.
Turvallisuus ja riskit
Kemikaalien luokitusta ja merkintöjä koskevan maailmanlaajuisesti yhdenmukaistetun järjestelmän vaaratekijät (SGA)
Maailmanlaajuisesti yhdenmukaistettu kemikaalien luokitus- ja merkintäjärjestelmä (SGA) on kansainvälisesti hyväksytty järjestelmä, jonka Yhdistyneet Kansakunnat on luonut ja joka on suunniteltu korvaamaan eri maissa käytetyt erilaiset luokitus- ja merkintävaatimukset käyttämällä yhdenmukaisia kriteerejä maailmanlaajuisesti.
Vaaraluokat (ja niiden vastaava luku GHS: stä), luokitus- ja merkintästandardit sekä suositukset natriumsulfidille ovat seuraavat (Euroopan kemikaalivirasto, 2017, Yhdistyneet Kansakunnat, 2015, PubChem, 2017):







viittaukset
- Benjah-bmm27, (2006). Fluoriitti-yksikkö-solu-3D-ioninen [kuva] Haettu osoitteesta wikipedia.org.
- ChemIDplus, (2017). 1313-82-2 [kuva] Haettu osoitteesta: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-rakenne 1313-82-2 - natriumsulfidi [kuva] Haettu osoitteesta: chem.nlm.nih.gov.
- ChemIDplus, (2017). 3D-rakenne 1313-84-4 - natriumsulfidi [kuva] Haettu osoitteesta chem.nlm.nih.gov.
- Euroopan kemikaalivirasto (ECHA). (2017). Yhteenveto luokituksesta ja merkinnöistä.
- Yhdenmukaistettu luokitus - asetuksen (EY) N: o 1272/2008 (CLP-asetus) liite VI. Natriumsulfidi. Haettu 16.1.2017 osoitteesta: echa.europa.eu.
- Euroopan kemikaalivirasto (ECHA). (2017). Yhteenveto luokituksesta ja merkinnöistä.
- Ilmoitettu luokitus ja merkinnät. Natriumsulfidi, hydratoitu. Haettu 16.1.2017 osoitteesta: echa.europa.eu.
- Vaarallisten aineiden tietopankki (HSDB). TOXNET. (2017). Natriumsulfidi. Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta: toxnet.nlm.nih.gov.
- Lange, L., ja Triebel, W. (2000). Sulfidit, polysulfidit ja sulfaanit. Ullmannin teollisuuskemian tietokirjassa. Wiley-VCH Verlag GmbH & Co. KGaA. Haettu osoitteesta dx.doi.org.
- Yhdistyneet Kansakunnat (2015). Maailmanlaajuisesti yhdenmukaistettu järjestelmä kemiallisten tuotteiden luokitusta ja merkintöjä varten (SGA) Kuudes tarkistettu versio. New York, Yhdysvallat: Yhdistyneiden Kansakuntien julkaisu. Haettu osoitteesta unece.org.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound -tietokanta. (2016). Natriumsulfidi enneahydraatti - PubChem-rakenne [kuva] Haettu osoitteesta pubchem.ncbi.nlm.nih.gov.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound -tietokanta. (2017). Natriummonosulfidi. Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta pubchem.ncbi.nlm.nih.gov.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound -tietokanta. (2017). Natriumsulfidi enneahydraatti. Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta pubchem.ncbi.nlm.nih.gov.
- National Oceanic ja Atmospheric Administration (NOAA). CAMEO Kemikaalit. (2017). Kemiallinen tietolomake. Natriumsulfidi, vedetön. Silver Spring, MD. EU: ssa; Haettu osoitteesta cameochemicals.noaa.gov.
- National Oceanic ja Atmospheric Administration (NOAA). CAMEO Kemikaalit. (2017). Reactive Group -datalehdet. Sulfidit, epäorgaaniset. Silver Spring, MD. EU: ssa; Haettu osoitteesta cameochemicals.noaa.gov.
- Ondřej Mangl, (2007). Sulfid sodný - Na2S [image] Haettu osoitteesta wikipedia.org.
- PubChem, (2016). Natriummonosulfidi [kuva] Haettu osoitteesta puchem.nlm.nih.gov.
- PubChem, (2016). Natriumsulfidi enneahydraatti [kuva] Haettu osoitteesta puchem.nlm.nih.gov.
- Wikipedia. (2017). Oktanoli-vesi-jakaantumiskerroin. Haettu 17. tammikuuta 2017 alkaen: wikipedia.org.
- Wikipedia. (2017). Natriumsulfidi. Haettu 17. tammikuuta 2017 alkaen: wikipedia.org.


