Raoultin laki, mitä se sisältää, positiiviset ja negatiiviset poikkeamat
Raoultin laki Ranskan kemisti François-Marie Raoult ehdotti sitä vuonna 1887, ja sen tarkoituksena on selittää kahden sekoittuvan aineen (tyypillisesti ihanteellinen) liuoksen höyrynpaineen käyttäytyminen kunkin tässä osassa olevan komponentin höyrynpaineen mukaan..
On olemassa kemian lakeja, joita käytetään kuvaamaan aineiden käyttäytymistä erilaisissa olosuhteissa ja selittämään ilmiöitä, joihin ne liittyvät, käyttäen tieteellisesti todistettuja matemaattisia malleja. Raoultin laki on yksi näistä.

Kaasujen (tai nesteiden) molekyylien vuorovaikutuksiin perustuvan selityksen käyttäminen höyrynpaineiden käyttäytymisen ennustamiseksi käytetään tätä lakia ei-ihanteellisten tai todellisten ratkaisujen tutkimiseen edellyttäen, että tarvittavat kertoimet katsotaan korjaavan mallia matemaattinen ja säädä se ei-ihanteellisiin olosuhteisiin.
indeksi
- 1 Mitä se koostuu??
- 2 Positiiviset ja negatiiviset poikkeamat
- 2.1 Positiiviset poikkeamat
- 2.2 Negatiiviset poikkeamat
- 3 Esimerkkejä
- 3.1 Perusseos
- 3.2 Binäärinen seos, jossa on haihtumaton liuos
- 4 Viitteet
Mitä se koostuu??
Raoultin laki perustuu olettamukseen, että mukana olevat ratkaisut toimivat ihanteellisella tavalla: tämä johtuu siitä, että tämä laki perustuu ajatukseen siitä, että molekyylien väliset molekyylien väliset voimat ovat samat kuin vastaavien molekyylien väliset voimat se ei ole niin onnistunut todellisuudessa.
Itse asiassa, mitä lähempänä ratkaisu on ihanteellisuudelle, sitä enemmän sen on täytettävä tämän lain ehdot..
Tämä laki liittyy liuoksen höyrynpaineeseen, jossa on haihtumaton liuos, ja todetaan, että se on saman puhtaan liuoksen höyrynpaine samassa lämpötilassa kerrottuna sen mooliosalla. Tämä ilmaistaan matemaattisin ehdoin yksittäiselle komponentille seuraavasti:
Pminä = Pºminä . Xminä
Tässä lausekkeessa Pminä on yhtä suuri kuin komponentin i osittainen höyrynpaine kaasuseoksessa, Pºminä on puhtaan komponentin i ja X höyrynpaineminä on komponentin i mooliosuus seoksessa.
Samalla tavoin, kun ratkaisussa on useita komponentteja ja ne ovat saavuttaneet tasapainotilan, voit laskea liuoksen kokonaishöyrynpaineen yhdistämällä Raoultin lain Daltonin:
P = PºX + PºBXB + PºCXC...
Myös sellaisissa liuoksissa, joissa on vain yksi liukoinen aine ja liuotin, lain voidaan muotoilla seuraavasti:
P = (1-XB) x Pº
Positiiviset ja negatiiviset poikkeamat
Ratkaisut, joita voidaan tutkia tämän lain mukaan, pitäisi normaalisti käyttäytyä ihanteellisesti, koska niiden molekyylien väliset vuorovaikutukset ovat pieniä ja sallivat samojen ominaisuuksien ottamisen koko ratkaisun ajan poikkeuksetta..
Todelliset ratkaisut ovat kuitenkin käytännössä olemattomia, joten laskelmiin, jotka edustavat molekyylien välisiä vuorovaikutuksia, on sisällytettävä kaksi kerrointa. Nämä ovat häiriökerroin ja aktiivisuuskerroin.
Tässä mielessä poikkeamat Raoultin lain suhteen määritellään positiivisiksi tai negatiivisiksi, riippuen tuolloin saaduista tuloksista.
Positiiviset poikkeamat
Positiiviset poikkeamat Raoultin lakiin nähden ilmenevät, kun liuoksen höyrynpaine on suurempi kuin Raoultin lain mukaan laskettu.
Tämä tapahtuu, kun samanlaisten molekyylien väliset yhteenkuuluvuusvoimat ovat suurempia kuin samat voimat eri molekyylien välillä. Tässä tapauksessa molemmat komponentit höyrystyvät helpommin.
Tämä poikkeama nähdään höyrynpaineen käyrässä maksimipisteenä tietyssä koostumuksessa, jolloin muodostuu positiivinen atseotrooppi.
Atseotrooppi on kahden tai useamman kemiallisen yhdisteen nestemäinen seos, joka käyttäytyy kuin se muodostuisi yhdestä ainoasta komponentista ja joka haihtuu muuttamatta koostumusta.
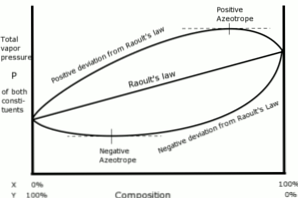
Negatiiviset poikkeamat
Negatiiviset poikkeamat Raoultin lainsäädännöstä ilmenevät, kun seoksen höyrynpaine on pienempi kuin odotettiin lain laskemisen jälkeen.
Nämä poikkeamat ilmenevät, kun seoksen molekyylien väliset koheesiovoimat ovat suurempia kuin nesteiden hiukkasten väliset voimat niiden puhtaassa tilassa.
Tämäntyyppinen poikkeama luo kunkin komponentin pidätyksen nestemäisessä tilassaan houkuttelevilla voimilla, jotka ovat suurempia kuin aineen puhtaan tilan, niin että järjestelmän osahöyrynpaine pienenee.
Höyrynpaineen käyrissä olevat negatiiviset atseotrooppit edustavat minimipistettä ja osoittavat affiniteetin kahden tai useamman seokseen sisältyvän komponentin välillä.
esimerkit
Raoultin lakia käytetään yleisesti laskemaan liuoksen paine, joka perustuu sen molekyylien välisiin voimiin, vertaamalla laskettuja arvoja todellisiin arvoihin, jotta voidaan päätellä, onko poikkeamia ja jos sen pitäisi olla positiivinen tai negatiivinen. Alla on kaksi esimerkkiä Raoultin lain käytöstä:
Basic-seos
Seuraava seos, joka koostuu propaanista ja butaanista, edustaa höyrynpaineen likiarvoa, ja voimme olettaa, että molemmat komponentit ovat siinä samassa suhteessa (50-50) 40 ° C: n lämpötilassa:
Xpropaani = 0,5
Pºpropaani = 1352,1 kPa
Xbutaani = 0,5
Pºbutaani = 377,6 kPa
Se lasketaan Raoultin lain mukaan:
Pseos = (0,5 x 377,6 kPa) + (0,5 x 1352,1 kPa)
joten:
Pseos = 864,8 kPa
Binäärinen seos, jossa on haihtumaton liuos
Joskus tapahtuu, että seoksen liukoisuus ei ole haihtuva, joten lakia käytetään ymmärtämään höyrynpaineen käyttäytymistä.
Kun otetaan huomioon veden ja sokerin seos suhteessa 95% ja 5% ja normaaleissa lämpötiloissa:
Xvesi = 0,95
Pºvesi = 2,34 kPa
Xsokeri = 0,05
Pºsokeri = 0 kPa
Se lasketaan Raoultin lain mukaan:
Pseos = (0,95 x 2,34 kPa) + (0,05 x 0 kPa)
joten:
Pseos = 2,22 kPa
On selvää, että vesihöyryn paine on laskenut molekyylien välisten voimien vaikutuksesta.
viittaukset
- Anne Marie Helmenstine, P. (s.f.). Raoultin lakimääritelmä. Haettu osoitteesta thinkco.com
- ChemGuide. (N.D.). Raoultin laki ja ei-haihtuvat ratkaisut. Haettu osoitteesta chemguide.co.uk
- LibreTexts. (N.D.). Raoultin laki ja nesteiden ihanteelliset seokset. Haettu osoitteesta chem.libretexts.org
- Neutrium. (N.D.). Raoultin laki. Haettu osoitteesta neutrium.net
- Wikipedia. (N.D.). Raoultin laki. Haettu osoitteesta en.wikipedia.org


