Ziehl-Neelsen Stain Foundation, reagenssit ja tekniikka
Ziehl-Neelsen tahraa värjäysmenetelmässä alkoholin happoa kestävien mikro-organismien (AAR) tunnistamiseksi. Tämän mikrobiologisen menettelyn nimi viittaa sen tekijöihin: bakteriologi Franz Ziehl ja patologi Friedrich Neelsen.
Tämä tekniikka on erilaista värjäystä, joka edellyttää erilaisten väriaineiden käyttöä kontrastin aikaansaamiseksi rakenteiden välillä, joita haluat tarkkailla, erottaa ja myöhemmin tunnistaa. Ziehl-Neelsen -väriainetta käytetään tiettyjen mikro-organismien tunnistamiseen.
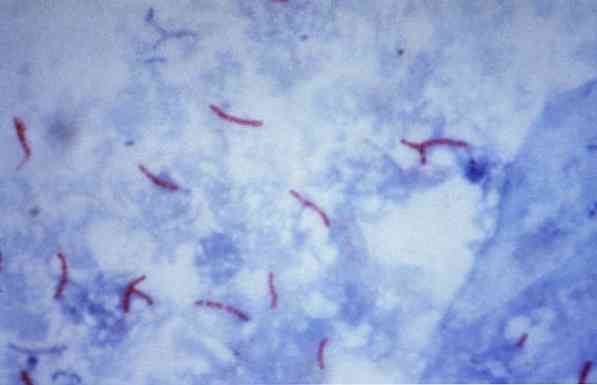
Jotkut näistä mikro-organismeista ovat mykobakteereja (esimerkiksi, Mycobacterium tuberculosis), nokardiat (esimerkiksi, Nocardia sp.) ja joitakin yksisoluisia loisia (esimerkiksi, Cryptosporidium parvum). Monet bakteerit voidaan luokitella yleisen tekniikan avulla, jota kutsutaan Gram-väriksi.
Jotkin bakteeriryhmät vaativat kuitenkin muita menetelmiä niiden tunnistamiseksi. Tekniikat, kuten Ziehl-Neelsen -värjäys, edellyttävät väriaineiden yhdistelmää lämmön kanssa ensimmäisen kiinnittämiseksi soluseinään.
Sitten tulee värinpoistoprosessi, joka mahdollistaa kaksi tulosta: vastustuskyky tai herkkyys hapot ja alkoholit värjäytymiselle.
indeksi
- 1 Säätiö
- 1.1 Toissijainen väritys
- 2 reagenssia
- 2.1 Ensisijainen väritys
- 2.2 Värinpoistoratkaisu
- 2.3 Toissijainen värjäys (väriaine)
- 3 Tekniikka
- 3.1 Happopitoinen värjäysmenetelmä
- 4 Viitteet
perusta
Tämän värjäysmenetelmän perusta perustuu näiden mikro-organismien soluseinän ominaisuuksiin. Seinä muodostuu mykolihappoiksi kutsuttujen rasvahappojen tyypistä; Näille on ominaista hyvin pitkät ketjut.
Kun rasvahapoilla on hyvin pitkät rakenteet, ne voivat säilyttää väriaineita helpommin. Eräitä bakteerien sukuja on erittäin vaikea tahrata Gram-värjäyksellä, koska soluseinän korkea mikolihappopitoisuus on.
Ziehl-Neelsen -värjäyksessä käytetään fenoliyhdisteen karbolifuksiiniä, perusväriainetta. Tällä on kyky vuorovaikutuksessa soluseinän rasvahappojen kanssa, joka on vahamainen koostumus huoneenlämpötilassa.
Carbol fuchsin -värjäys paranee lämmön läsnä ollessa, koska vaha sulaa ja värimolekyylit liikkuvat nopeammin soluseinään.
Myöhemmin käytettävä happo pyrkii värjäämään ne solut, joita ei värjätty, koska niiden seinämä ei ollut riittävästi yhteydessä väriaineeseen; siksi hapon värjäytimen lujuus kykenee poistamaan happovärin. Soluja, jotka vastustavat tätä värinmuutosta, kutsutaan haponkestäviksi.
Toissijainen väritys
Näytteen värjäytymisen jälkeen tämä on kontrastia toiselle väriaineelle, jota kutsutaan toissijaiseksi väriaineeksi. Yleensä käytetään metyleenisinistä tai malakiitinvihreää.
Toissijainen väri värjää taustamateriaalin ja siten muodostaa kontrastin ensimmäisessä vaiheessa värjätyille rakenteille. Vain värjätyt solut absorboivat toisen väriaineen (anti-tahra) ja ottavat värinsä, kun taas haponkestävät solut säilyttävät punaisen värin.
Tätä menettelyä käytetään usein tunnistamiseen Mycobacterium tuberculosis ja Mycobacterium leprae, joita kutsutaan happo-nopeiksi bacilleiksi.
reagenssit
Ensisijainen väritys
Käytetään 0,3% karboksiinin fukssiiniä (suodatettu). Tämä väriaine valmistetaan alkoholien: fenolin seoksesta etanolissa (90%) tai metanolissa (95%), ja tässä seoksessa liuotetaan 3 grammaa emäsfuksiinia.
Värinpoistoratkaisu
Tässä vaiheessa voit käyttää liuoksia, joissa on 3% alkoholihappoa tai 25% rikkihappoa.
Toissijainen väri (väriaine)
Näytteen kontrastin suorittamiseen yleisimmin käytetty väriaine on tavallisesti 0,3% metyleenisinistä. Voidaan kuitenkin käyttää myös muita, kuten 0,5% malakiitinvihreää.
tekniikka
Happopitoinen värjäysmenetelmä
Valmistele bakteeriä
Tämä valmiste valmistetaan puhtaalla ja kuivalla liuoksella steriiliyden varotoimenpiteiden jälkeen.
Mausteen kuivaus
Anna annoksen kuivua huoneenlämpötilassa.
Kuumenna näyte
Näyte on lämmitettävä levittämällä alla olevaa liukua. Alkoholiin kiinnittyminen voidaan tehdä, kun rasvaa ei ole valmistettu syljen kanssa (käsitelty natriumhypokloriitilla valkaisua varten) ja jos sitä ei värjää välittömästi..
M. tuberculosis Se eliminoituu valkaisuaineella ja värjäysprosessin aikana. Käsittelemättömän sputumin lämpökiinnitys ei tapa M. tuberculosis, alkoholiin sitoutuminen on bakterisidistä.
Peitä tahra
Maali peitetään karbolifuksiiniliuoksella (primäärinen perusvärjäys).
Lämmitä tahra
Tämä tehdään 5 minuutin ajan. Huomioi höyryn vapautuminen (noin 60 ° C). On tärkeää olla ylikuumentumatta ja välttää näytteen polttamista.
Maalauksen kuumentamisen osalta on kiinnitettävä erityistä huomiota fuksiinikarbolin lämmitykseen, varsinkin jos värjäys suoritetaan alustalla tai muulla säiliöllä, jossa aiemmasta tahrasta on kerätty helposti syttyviä kemikaaleja..
Levyjen alle tulisi levittää vain pieni liekki käyttämällä valaistua vanupuikkoa, joka on aiemmin kostutettu muutama pisara happoalkoholia, metanolia tai 70% etanolia. Vältä etanoliin liotettua suurta vanupuikkoa, koska se on palovaara.
Pese tahra
Tämä pesu tulisi tehdä puhtaalla vedellä. Jos vesijohtovesi ei ole puhdas, pese lika suodatetulla tai tislatulla vedellä, mieluiten.
Peitä lika happamalla alkoholilla
Tämän happaman alkoholin tulisi olla 3%. Kattavuus suoritetaan 5 minuutin ajan tai kunnes värjäys on riittävän värjäytynyt, eli vaaleanpunainen.
On otettava huomioon, että happo alkoholi on syttyvää; siksi sitä on käytettävä hyvin huolellisesti. Vältä lähelle sytytyslähteitä.
Pese tahra
Pesun tulisi olla puhdasta, tislattua vettä.
Peitä lika väriaineella
Se voi olla vihreä malakiitti (0,5%) tai metyleenisininen (0,3%) väriaine 1 tai 2 minuutin ajan käyttäen pisintä aikaa, jos tahra on ohut.
Pese tahra
Puhdasta vettä on käytettävä uudelleen (tislattu).
valua
Liuoksen takaosa on puhdistettava ja tahra sijoitettava viemärihyllyyn siten, että se kuivataan ilmalla (älä käytä imukykyistä paperia kuivaukseen).
Tarkasta mikroskooppi
Käytä 100X-tavoitetta ja upotusöljyä. Tarkasta tahriintuminen järjestelmällisesti ja kirjoita merkitykselliset havainnot.
Tulkitse tuloksia
Teoreettisesti punaista väriä värjättyjä mikro-organismeja pidetään happo-nopeina positiivisina (AAR +).
Päinvastoin, jos mikro-organismit värjätään sinisenä tai vihreänä, riippuen väriaineena käytetystä väriaineesta, niitä pidetään negatiivisina alkoholinkestävinä happoina (AAR-).
viittaukset
- Apurba, S. & Sandhya, B. (2016). Käytännön mikrobiologian perusteet (Ensimmäinen toim.). Jaypee Brothers Medical Publishers.
- Bauman, R. (2014). Mikrobiologia ja sairaudet kehon järjestelmällä (4. painos). Pearson Education, Inc..
- Heritage, J., Evans, E. & Killington, A. (1996). Mikrobiologia (Ensimmäinen toim.). Cambridge University Press.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). Laboratoriokäsikirja ja mikrobiologian työkirja: sovellukset potilaan hoitoon (11. painos). McGraw-Hill koulutus.
- Vasanthakumari, R. (2007). Mikrobiologian oppikirja (Ensimmäinen toim.). B. I. Julkaisut PVT.


