Giemsan värjäyspohja, materiaalit, tekniikka ja käyttötarkoitukset
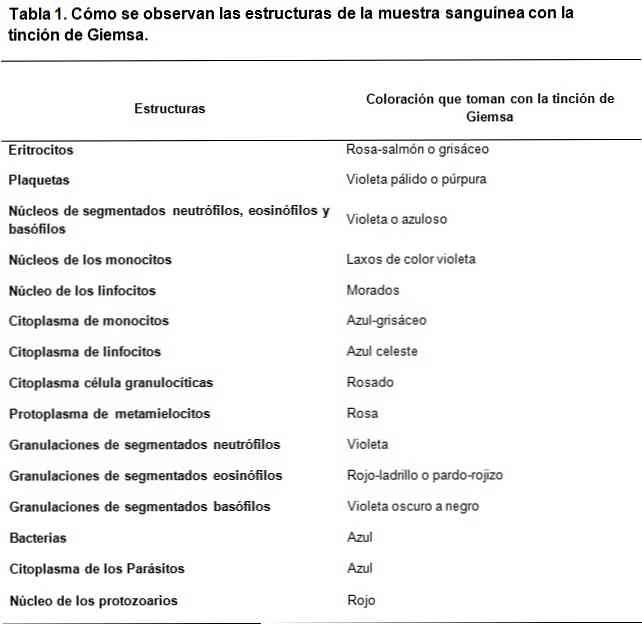
Giemsa tahraa on eräänlainen kliinisten näytteiden värjäys, joka perustuu happo- ja emäksisten väriaineiden seokseen. Sen luomista inspiroi Romanowskin tekemä työ, jossa Saksasta peräisin oleva kemisti ja bakteriologi Gustav Giemsa täydentää sitä lisäämällä glyserolia yhdisteiden stabiloimiseksi..
Romanowskin alkuperäiseen tekniikkaan tehdyt muutokset saivat parantaa huomattavasti mikroskooppisia havaintoja, joten tekniikka kastettiin Giemsa-värin avulla.
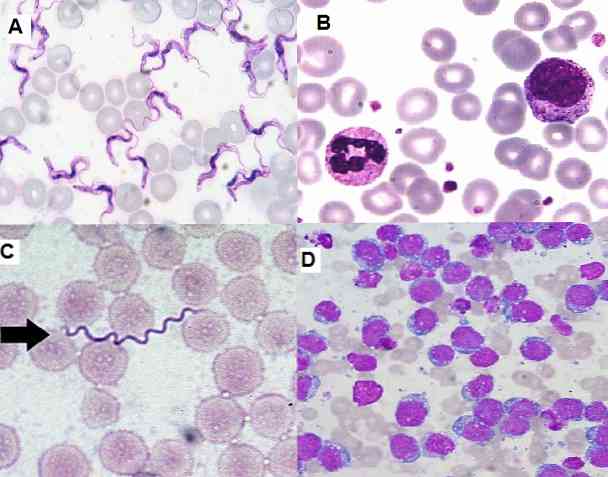
Koska se on yksinkertainen tekniikka, joka on erittäin toimiva ja taloudellinen, sitä käytetään tällä hetkellä laajalti kliinisessä laboratoriossa hematologisten tahrojen, luuydinnäytteiden ja kudososien osalta..
Giemsan värjäystekniikka on erittäin hyödyllinen sytologisiin tutkimuksiin, koska se sallii solujen spesifisten rakenteiden havainnoinnin. Tämä tekniikka tahraa solujen sytoplasmat, ytimet, nukleiinit, vacuolit ja rakeet, jotta ne voivat erottaa jopa hienoja kromatiinin jälkiä.
Lisäksi voidaan havaita merkittäviä muutoksia ytimen koossa, muodossa tai värityksessä, missä on mahdollista visualisoida ytimen ja sytoplasman välisen suhteen menetys.
Toisaalta sen avulla voidaan tunnistaa luuytimen ja perifeerisen veren kehittymättömät solut, jotka ovat tärkeitä vakavien sairauksien, kuten leukemian, diagnosoinnissa. On myös mahdollista havaita mm. Hemoparasiitteja, ylimääräisiä ja solunsisäisiä bakteereita, sieniä.
Sytogeneettisessä tutkimuksessa sitä käytetään melkoisesti, koska solujen mitoosia on mahdollista tutkia.
indeksi
- 1 Giemsa-värin perustaminen
- 2 Materiaalit
- 2.1 Materiaalit emoliuoksen valmistamiseksi
- 2.2 Emoliuoksen valmistustapa
- 2.3 Materiaalit puskuriliuoksen valmistamiseksi
- 2.4 Väriaineen lopullinen valmistus
- 2.5 Väriaineen suorittamiseen tarvittavat lisäaineet
- 3 Tekniikka
- 3.1 Värjäysprosessi
- 4 Apuohjelmat
- 4.1 Hematologia
- 4.2 Mycology
- 4.3 Bakteriologia
- 4.4 Parasitologia
- 4.5 Sytologia
- 4.6 Sytogenetiikka
- 5 Giemsa-värjäyksen tehokkuutta osoittava tutkimus
- 6 Suositukset hyvästä värjäyksestä
- 7 Yleisiä virheitä Giemsan värityksessä
- 7.1 Erittäin sininen väri
- 7.2 Liian vaaleanpunainen väri
- 7.3 Saostumien esiintyminen likaantumisessa
- 7.4 Morfologisten esineiden esiintyminen
- 8 Tallennustila
- 9 Viitteet
Giemsa-värin perustaminen
Romanowskin tyypin väriaineet perustuvat happo- ja emäksisten väriaineiden välisen kontrastin käyttöön perus- ja happorakenteiden värjäyksen aikaansaamiseksi. Kuten voidaan nähdä, happoväriaineiden affiniteetti on perusrakenteiden värjäykseen ja päinvastoin.
Käytetty perusväri on metyleenisininen ja sen hapettuneet johdannaiset (Azure A ja Azure B), kun taas happoväri on eosiini.
Solujen happorakenteet ovat muun muassa segmentoitujen basofiilien rakeita sisältäviä nukleiinihappoja, joten ne värjätään metyleenisinisellä.
Tässä samassa mielessä solujen perusrakenteet ovat hemoglobiini ja jotkut rakeet, kuten ne, jotka sisältyvät segmentoituihin eosinofiileihin; nämä värjätään eosiinilla.
Toisaalta johtuen siitä, että metyleenisinisellä ja taivaansininen on tunnusomaista metakromaattisilla väriaineilla, ne voivat aikaansaada vaihtelevan sävyn eri rakenteille niiden polyanionien kuormituksen mukaan..
Näin perus- ja happoväriaineiden strateginen yhdistelmä kykenee kehittämään monenlaisia värejä kunkin rakenteen biokemiallisten ominaisuuksien mukaan, kävelemällä vaaleansinisen, tummansinisen, lila- ja violettisävyin läpi happamien rakenteiden tapauksessa..
Vaikka eosinin väritys on vakaampi, se tuottaa värejä punertavan oranssin ja lohen välillä.
tarvikkeet
Materiaalit emoliuoksen valmistamiseksi
Varastoliuoksen valmistus vaatii painon 600 mg jauheena olevaa Giemsa-väriainetta, joka mittaa 500 cm3 asetonitonta metyylialkoholia ja 50 cm3 neutraalia glyseriiniä.
Emoliuoksen valmistustapa
Aseta raskas Giemsa-jauhe laastiin. Jos on paloja, ne on ruiskutettava. Tämän jälkeen lisätään huomattava määrä mitattua glyserolia ja sekoita hyvin. Saatu seos kaadetaan erittäin puhtaaseen keltaiseen pulloon.
Loput glyseriinistä sijoitetaan laastiin. Sekoita uudelleen, jotta jäljellä oleva väriaine, joka on kiinnitetty laastin seiniin, on puhdistettu ja kaada samaan pulloon.
Pullo peitetään ja kuljetetaan 2 tuntia vesihauteessa 55 ° C: ssa. Sekoita seosta bain-marie-kylpyammeessa kevyesti puolen tunnin välein.
Sen jälkeen seoksen annetaan jäähtyä alkoholin asettamiseksi. Aikaisemmin osa mitatusta alkoholista sijoitetaan laastiin, jotta se lopettaa väriaineen jäljellä olevan pesun, ja sitten se lisätään seokseen yhdessä muun alkoholin kanssa..
Tämän valmisteen annetaan kypsyä vähintään 2 viikkoa. Emoliuoksesta käytettävä osa on suodatettava.
Valmisteen kontaminaation välttämiseksi on suositeltavaa siirtää se osa, joka on jatkuvasti käytössä pieneen keltaiseen pulloon, jossa on tiputinta. Lataa aina, kun reagenssi loppuu.
Materiaalit puskuriliuoksen valmistamiseksi
Toisaalta valmistetaan puskuriliuos, jonka pH on 7,2, seuraavasti:
Punnitaan 6,77 grammaa (vedetöntä) natriumfosfaattia (NaHPO4), 2,59 g kaliumdivetyfosfaattia (KH)2PO4) ja tislattua vettä jopa 1000 cm3: een.
Väriaineen lopullinen valmistus
Lopullisen värjäysliuoksen valmistamiseksi mitataan 2 cm3 suodatettua varastoliuosta ja sekoitetaan 6 ml: aan puskuriliuosta. Seosta sekoitetaan.
Tärkeä seikka, joka on otettava huomioon, on se, että väriaineen valmistusmenetelmät voivat muuttua kaupallisen talon mukaan.
Väriaineen suorittamiseen tarvittavat lisämateriaalit
Kuvattujen materiaalien lisäksi se on varustettava värisilloilla, vesinäytöillä tai pesupuskurilla, esineiden tai kansien arkkeilla, sekuntikellolla väriaikojen hallitsemiseksi ja paperin tai jonkin materiaalin kuivaukseen ( sideharso tai puuvilla).
tekniikka
Värjäysprosessi
1) Ennen värjäystä näytteen leviäminen on suoritettava puhtaaseen diaan..
Näytteet voivat olla veri, luuydin, histologisten kudosten leikkaukset tai kohdunkaulan emättimen näytteet. On suositeltavaa, että ulkoasut ovat ohuita ja niiden kuivaus on 1 tai 2 tuntia ennen niiden värjäämistä.
2) Kaikki värilliset levyt asetetaan värilliselle sillalle. Työskentele aina samassa järjestyksessä ja tunnista jokainen arkki hyvin.
3) Laita muutama tippa 100-prosenttista metyylialkoholia (metanolia) likaantumiseen ja jätä 3–5 minuuttia näytteen kiinnittämiseksi ja dehydratoimiseksi..
4) Hävitä levyssä oleva metanoli ja anna sen kuivua.
5) Kuivaa lopullinen värjäysliuos pisaraan, kunnes koko arkki on peitetty. Jätä 15 minuuttia. Jotkut tekijät suosittelevat jopa 25 min. Riippuu kaupallisesta talosta.
6) Tyhjennä väriaine ja pese tahra tislatulla vedellä tai 7,2 puskuriliuoksella.
7) Levypaperia varten annetaan levyt kuivua ulkona, pystysuoraan, tukikappaleen avulla.
8) Pyyhi liu'un takana oleva sideharso tai puuvillapyyhke, joka on kostutettu alkoholilla jäljellä olevan väriaineen poistamiseksi.
apuohjelmia
Giemsa-värjäysmenetelmää käytetään useilla aloilla, kuten: hematologiassa, mykologiassa, bakteriologiassa, parasitologiassa, sytologiassa ja sytogeneettisessä tutkimuksessa..
hematologian
Se on tämän värjäyksen yleisin apuohjelma. Sen avulla voimme tunnistaa jokaisen solun, joka on läsnä luuytimen tai perifeerisen veren näytteissä. Lisäksi arvioidaan kunkin sarjan lukumäärä, jotta pystytään havaitsemaan leukosytoosia tai leukopeniaa, trombosytopeniaa jne..
Koska se on herkkä kypsymättömien solujen tunnistamiseksi, se on tärkeää akuuttien tai kroonisten leukemioiden diagnosoinnissa. On myös mahdollista diagnosoida mm. Anemian, kuten sirppisolun taudin, sirppisolun taudin, diagnosointi..
mykologian
Tällä alueella on yleistä käyttää sitä etsimään Histoplasma capsulatum (solunsisäinen dimorfinen sieni) kudosnäytteissä.
bakteerioppi
Giemsalla värjäytyneissä hematologisissa tahroissa on mahdollista havaita Borrelias sp potilailla, joilla on sairaus, jota kutsutaan kuumeeksi. Spirokeetit ovat runsaasti erytrosyyttien joukossa, näytteissä, jotka on otettu kuumeisen piikin kohdalla.
On myös mahdollista visualisoida solunsisäisiä bakteereja kuten Rickettsias sp ja Chlamydia trachomatis tartunnan saaneissa soluissa.
parasitologia
Parasiitologian alalla Giemsa-värjäys on mahdollistanut loisairauksien, kuten malarian, Chagasin taudin ja leishmaniaasin, diagnosoinnin..
Kahdessa ensimmäisessä parasiitissa Plasmodium sp ja Trypanosoma cruzi vastaavasti ne voidaan visualisoida tartunnan saaneiden potilaiden perifeerisessä veressä, ne löytyvät eri vaiheista sen vaiheen mukaan, jossa tauti on.
Veren loisten etsinnän parantamiseksi on suositeltavaa käyttää Giemsa-tahraa, joka on sekoitettu May-Grünwald-väriaineen kanssa.
Samoin ihon leishmaniaasia voidaan diagnosoida arvioitaessa Giemsalla värjättyjen iho-biopsioiden näytteitä, joissa loinen löytyy.
soluoppi
Giemsan värjäystä käytetään myös endokervikaalisten näytteiden sytologiseen tutkimukseen, vaikka se ei ole tähän tarkoitukseen eniten käytetty tekniikka.
Mutta resurssien niukkuudessa voidaan käyttää Papanicolaou-tekniikan tarjoamia ominaisuuksia ja pienempiä kustannuksia. Se vaatii kuitenkin asiantuntijan asiantuntemusta.
sytogenetiikka
Giemsa-värjäyksen merkityksellinen piirre on sen kyky sitoutua voimakkaasti DNA-adeniinien ja tymiinien runsaisiin alueisiin. Tämä sallii DNA: n visualisoinnin solujen mitoosin aikana eri kondensaatiotiloissa.
Nämä tutkimukset ovat välttämättömiä kromaattisten poikkeamien, kuten kromosomien eri alueiden duplikaatioiden, deleetioiden tai translokaatioiden, havaitsemiseksi..
Giemsa-värjäyksen tehokkuutta osoittava tutkimus
Cannova et ai. (2016) verrattiin 3 väritystekniikkaa ihon leishmaniaasin diagnosoimiseksi.
Tätä varten he käyttivät kokeellisesta eläimestä saatuja näytteitä (Mesocrisetus auratus) kokeellisesti inokuloitu Leishmaniasilla.
Kirjoittajat osoittivat, että Giemsa-värjäys oli parempi kuin Pap-mart® ja Gaffney-värjäys. Siksi he katsoivat, että Giemsa-tahra on ihanteellinen ihon leishmaniaasin diagnosoimiseksi.
Kirjoittajien saamat erinomaiset tulokset johtuvat siitä, että Giemsa-seoksen muodostavien väriaineiden yhdistelmä antaa tarvittavat edellytykset suotuisan kontrastin luomiselle, jolloin amastigote-rakenteet voidaan erottaa selvästi sekä sisäisesti että solun ulkopuolelta..
Myös muut tekniikat (Pap-Mart® ja Gaffney) tekivät sen, mutta heikommalla tavalla ja siksi vaikeampi visualisoida. Siksi Giemsa-värjäystä suositellaan leishmaniasiksen parasitologiseen diagnoosiin.
Samoin Ramírez et al: n (1994) tutkimuksessa arvioitiin Giemsa- ja Lendrum-tahrojen pätevyyttä konjunktiivisissa tahroissa, jotta voitaisiin tunnistaa Chlamydia trachomatis.
Tekijät totesivat, että Giemsa- ja Ledrum-värjäyksillä on sama spesifisyys, mutta Giemsa oli herkempi.
Tämä selittää, miksi Giemsan värjäys on tällä hetkellä useimmiten käytetty klamydiainfektioiden diagnosoinnissa, varsinkin jos resursseja on vähän.
Suositukset hyvästä värjäyksestä
Levyjen kuivausta ei saa nopeuttaa. Varovaisuusaikaa on odotettava sen kuivattamiseksi ulkona. Noin 2 tuntia.
Saat parhaat tulokset heti 2 tunnin kuluttua.
Jotta tahrat voidaan kiinnittää ja värjätä paremmin, näyte on levitettävä levylle siten, että ohut ja tasainen kerros jää jäljelle.
Edullinen verinäyte on kapillaari, koska leviäminen tehdään suoraan veripisarasta ja siksi näytteellä ei ole lisäainetta, joka suosii solurakenteiden ylläpitoa.
Jos kuitenkin käytetään laskimoveriä, EDTA: ta tulisi käyttää antikoagulanttina eikä hepariinina, koska jälkimmäinen yleensä deformoi solut.
Yleisiä virheitä Giemsan värityksessä
Tämän värin käytännössä voidaan tehdä virheitä. Niitä osoittavat äkilliset muutokset rakenteiden sävyissä.
Erittäin sininen väri
Se voi johtua:
- Erittäin paksut tahrat
- Maalausajan ylittäminen
- Liian vähän pesua.
- Reagenssien käyttö neutraalin pH: n yläpuolella (emäksinen).
Näissä olosuhteissa värit seuraavat rakenteet ovat vääristyneitä, jotta erytrosyytit sijaan, värjätty vaaleanpunainen-lohi on vihreä, rakeet eosinofiilien jotka pitäisi värjätä punatiilinen sinertävä tai harmaa kääntyy pois ja niin edelleen tahdosta poikkeama tavalliseen sävyjä.
Liian vaaleanpunainen väri
Se voi johtua:
- Riittämätön värjäysaika.
- Pitkäaikainen tai liiallinen pesu.
- Huono kuivaus.
- Erittäin happamien reagenssien käyttö.
Tällöin tavallisesti värjätyt rakenteet eivät ole melkein näkyvissä, kun taas värjätyt vaaleanpunaiset rakenteet ovat erittäin liioiteltuja..
Esimerkki: erytrosyytit saavat kirkkaan punaisen tai vahvan oranssin värin, ydinkromatiini näyttää vaaleanpunaiselta ja eosinofiilien rakeet tulevat kirkkaan punaisiksi..
Saostumien läsnäolo leviämässä
Syyt voivat olla:
- Käytä likaisia tai huonosti pestyjä arkkeja.
- Älä anna rasvan kuivua hyvin.
- Jätä kiinnitysliuos liian kauan.
- Riittämätön pesu värjäyksen lopussa.
- Käytettävän väriaineen suodatus tai suodattamattomuus.
Morfologisten esineiden esiintyminen
Morfologiset artefaktit voivat näkyä tahroissa, mikä vaikeuttaa näkyvien rakenteiden visualisointia ja tulkitsemista. Tämä johtuu:
- Käytetyn antikoagulantin tyyppi, kuten hepariini.
- Likaiset, vaurioituneet tai rasvaiset levyt.
Tallennustila
Valmistuksen jälkeen väriaine on säilytettävä huoneenlämmössä (15 - 25 ° C), jotta väriaine ei saostu. Se on säilytettävä suljetussa keltaisessa säiliössä.
viittaukset
- Cannova D, Brito E ja Simons M. Väritystekniikoiden arviointi ihon leishmaniaasin diagnosoimiseksi. Salus. 2016; 20 (2): 24 - 29.
- PanReac Applichem ITW -reagenssit. Giemsa tahraa. Versio 2: JMBJUL17 CEIVD10ES. Castellar del Vallés, Espanja.
- Clark G. Värjäysmenetelmät (1981), 4th. Williams & Willkins.
- Sovellettu kliininen kemia Giemsa-väriaine diagnosoimiseksi in vitro. Jakelija: cromakit.es
- Ramírez I, Mejía M, García de la Riva J, Hermes F ja Grazioso C. Giemsa- ja Lendrum-tahrojen voimassaolo sidekalvon tahroissa Chlamydia trachomatis. Bol of Sanit Panam. 1994; 116 (3): 212-216.
- Casas-Rincon G. Yleinen mykologia. 1994. 2nd Ed. Universidad Central de Venezuela, kirjastoversiot. Venezuela, Caracas.
- "Giemsa tahraa." Wikipedia, vapaa tietosanakirja. 1 syyskuuta 2017, 01:02 UTC. 6. joulukuuta 2018, en.wikipedia.org.


