Spore värjäys säätiö, tekniikat ja käyttötarkoitukset
itiöiden värjäys on menetelmä, jota käytetään värjättämään resistenssirakenteita, jotka muodostavat joitakin bakteeri- sukuja, kun ne ovat epäsuotuisissa olosuhteissa; nämä rakenteet vastaavat eloonjäämismenetelmää.
On monia sukuja, jotka muodostavat itiöitä; tärkeimmät ovat kuitenkin Bacillus ja Clostridium. Näitä sukuja pidetään merkityksellisempinä, koska niillä on ihmisille patogeenisiä lajeja.
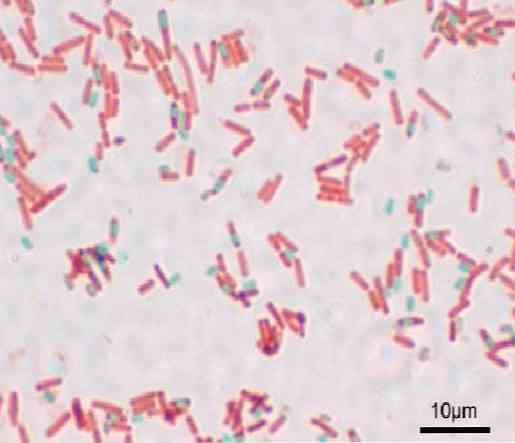
Jokainen bacillus voi aiheuttaa itiöitä. Valmistuksen värjäyksen aikana itiö löytyy bacilluksen (endospore) tai sen ulkopuolella (exospore). Tavallisilla bakteerien värjäysmenetelmillä, kuten Gram-värillä, itiöt pysyvät värittöminä.
Tällä hetkellä on useita väritysmenetelmiä, jotka pystyvät ylittämään itiön paksun rakenteen värjäämään sitä. Nämä menetelmät ovat hyvin erilaisia; Näistä voidaan mainita Dorner-tekniikka, Möeller-värjäys ja Shaeffer-Fulton -menetelmä, joka tunnetaan myös nimellä Wirtz-Conklin..
Kaikista mainituista tekniikoista Shaeffer-Fultonin menetelmä on eniten käytetty rutiinilaboratorioissa. Sen nimi on kaksi mikrobiologia, jotka luovat värin vuonna 1930: Alicia Shaeffer ja MacDonald Fulton. Toisinaan tekniikkaa kutsutaan Wirtz-Conkliniksi kahden 1900-luvun bakteriologin kunniaksi.
indeksi
- 1 Säätiö
- 2 Spore-väritystekniikat
- 2.1 Dornerin tekniikka
- 2.2 Muutettu Dorner-tekniikka
- 2.3 Shaeffer-Fultonin tai Wirtz-Conklinin tekniikka
- 2.4 Möeller-tekniikka
- 2.5 Möellerin muunnettu tekniikka ilman lämpöä
- 3 Käyttö
- 3.1 Esimerkkejä
- 4 Viitteet
perusta
Itiöt eivät tahraa tavanomaisilla väreillä, koska niillä on erittäin paksu muuri. Sporeiden monimutkainen koostumus estää useimpien väriaineiden pääsyn.
Jos itiöitä tutkitaan ulkopuolelta sisäpuolelle, seuraavat kerrokset havaitaan: ensinnäkin exosporium, joka on glykoproteiinien muodostama ohuin ulkokerros..
Sitten tulee kutikula, joka antaa vastustuskyvyn korkeille lämpötiloille, jota seuraa peptidoglykaanista koostuva kuori. Sitten on pohjan seinä, joka suojaa protoplastia.
Itiö on dehydratoitu rakenne, joka sisältää 15% kalsiumia ja dipikoliinihappoa. Siksi useimmat itiöiden väritystekniikat perustuvat lämmön levittämiseen siten, että väriaine voi tunkeutua paksuun rakenteeseen.
Kun itiö on värjätty, se ei voi poistaa väriainetta. Shaeffer-Fulton-tekniikassa malakiitin vihreä pääsee kasvullisiin soluihin ja lämpöä levittäessään tunkeutuu endosporeihin ja myös eksosporeihin.
Vedellä pesemällä väriaine poistetaan kasvisolusta. Tämä johtuu siitä, että vihreä malakiitin väri on hieman emäksinen, joten se sitoutuu heikosti kasvulliseen soluun.
Toisaalta se ei pääse ulos itiöstä ja lopulta bacillus safraniinilla on kontrastissa. Tämä perusta on voimassa muille tekniikoille, joissa tapahtuu jotain vastaavaa.
Spore-väritystekniikat
Jotta itiöt tahraaisivat, sinulla on oltava epäillyn kannan puhdas kulttuuri, jota haluat tutkia.
Viljelmälle altistetaan äärimmäisille lämpötiloille 24 tunnin ajan mikro-organismin stimuloimiseksi sporuloimalla. Tätä varten viljelmä voidaan sijoittaa uuniin 44 ° C: ssa tai jääkaapissa (8 ° C) 24 tai 48 tunnin ajan.
Jos mainittuihin lämpötiloihin jää liian paljon aikaa, vain exospores havaitaan, koska kaikki endosporit ovat jättäneet bacilluksen.
Ajan päätyttyä muutama tippa steriiliä fysiologista liuosta tulisi sijoittaa puhtaaseen liukumaan. Sitten otetaan pieni osa sadosta ja tehdään hieno leviäminen.
Sen jälkeen sen annetaan kuivua, se kiinnitetään lämpöön ja se värjätään joillakin seuraavista tekniikoista:
Dornerin tekniikka
1- Valmistetaan koeputkeen sporuloidun mikro-organismin väkevöity suspensio tislattuun veteen ja lisätään yhtä suuri tilavuus suodatettua kinyoun-fenolista fuksiinia.
2 Aseta putki kiehuvaan veteen 5–10 minuuttia.
3 - Sekoita puhtaaseen liukuhihnaan tippa edellistä suspensiota tippa 10% nigrosiinipitoista vesiliuosta, keitetty ja suodatettu.
4- Pidennä ja kuivaa nopeasti kevyellä lämmöllä.
5- Tutki 100X-tavoitetta (upottaminen).
Itiöt värjäytyvät punaisiksi ja bakteerisolut näyttävät melkein värittöminä tummanharmaalle taustalle.
Modifioitu Dorner-tekniikka
1 - Sporuloidun mikro-organismin suspensio levitetään liukumaan ja kiinnitetään lämpöön.
2 - Näyte on peitetty suodatinpaperipalalla, johon lisätään fenohappofuksiinia. Väriainetta kuumennetaan 5 - 7 minuuttia Bunsen-polttimen liekillä, kunnes höyryt vapautuvat. Sitten paperi poistetaan.
3 - Pese valmiste vedellä ja kuivaa sitten imukykyisellä paperilla.
4 - Peitä lika ohuella 10% nigrosiinikalvolla käyttäen toista diaa nigrosiinin tai neulan levittämiseksi..
Itiöiden ja bakteerien väritys on sama kuin tunnetussa tekniikassa kuvattu.
Shaeffer-Fultonin tai Wirtz-Conklinin tekniikka
1 - Laita ohut leviäminen sporuloidun mikro-organismin suspensiolla liukumaan ja kiinnitä se lämpöön.
2 - Peitä liuos vesipitoisella 5% malakiitin liuoksella (suodatinpaperi voidaan sijoittaa levylle).
3 - Kuumenna Bunsen-polttimen liekki, jotta höyry poistuu ja poistetaan liekki. Toista toimenpide 6–10 minuuttia. Jos malakiitin vihreä liuos haihtuu toimenpiteen aikana liian paljon, lisää voidaan lisätä.
4- Poista suodatinpaperi (jos se on asetettu) ja pese vedellä.
5- Peitä liuos 0,5-prosenttisella vesipitoisella safraniinilla 30 sekunnin ajan (jotkin tekniikan muunnokset käyttävät 0,1% vesipitoista safraniinia ja jättävät sen 3 minuutiksi).
Tällä tekniikalla itiöt ovat vihreitä ja bacillot ovat punaisia.
Haittana on se, että nuorten kulttuurien endosporit eivät tahraa hyvin, koska ne näyttävät erittäin kirkkailta tai värittöminä. Tämän välttämiseksi on suositeltavaa käyttää 48 tunnin inkubointia.
Möeller-tekniikka
1 - Peitä lika kloroformilla 2 minuutin ajan.
2- Hävitä kloroformi.
3 - Peitä 5% kromihappoa 5 minuutin ajan.
4 - Pese tislatulla vedellä
5- Levy on peitetty fuchsin-fenoli-karpkalla ja altistetaan Bunsen-polttimen liekille, kunnes höyryt päästetään; sitten se poistetaan liekistä hetkeksi. Toiminta toistetaan, kunnes se saavuttaa 10 minuuttia.
6- Pese vedellä.
7- Käytä happamoitunutta etanolia (suolahappoalkoholia) värin poistamiseksi. Se jää 20 tai 30 sekunnin ajan.
8- Pese tislatulla vedellä.
9 - Levyn peittäminen metyleenisinisellä 5 minuutin ajan.
10 - Pese tislatulla vedellä.
11- Se jätetään kuivumaan ja näyte otetaan mikroskoopilla.
Sporat näyttävät punaisilta ja sinisiltä bacillilta. On tärkeää, ettei höyryjä hengitetä, koska ne ovat myrkyllisiä ja pitkällä aikavälillä ne voivat olla syöpää aiheuttavia.
Modifioitu Möeller-tekniikka ilman lämpöä
Vuonna 2007 Hayama ja hänen yhteistyökumppaninsa loivat Möeller-tekniikan muutoksen. Ne poistivat väriaineen kuumennusvaiheen ja korvasivat sen lisäämällä 2 tippaa Tergitol 7-pinta-aktiivista ainetta jokaiseen 10 ml: aan fuchsiini-fenolista karboliliuosta. Samat tulokset saatiin.
sovellukset
Sporeiden väritys tarjoaa erittäin arvokkaan ja hyödyllisen informaation patogeenin tunnistamiseksi, koska saman läsnäolo, sen muoto, sijainti bacilluksessa ja kyky deformoida kasvissolu tai ei, ovat tietoja, jotka voivat ohjata lajia mukana tietyssä sukupuolessa.
Tässä yhteydessä on syytä mainita, että itiöt voivat olla pyöreitä tai soikeat, ne voivat sijaita keskellä tai myös parasentrisessa, subterminalisessa tai terminaalissa..
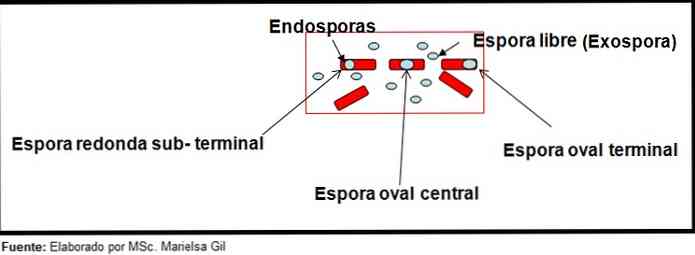
esimerkit
- Clostridium difficile muodostaa soikean itiön pääteasennossa, joka deformoi bacilluksen.
- Spore of Clostridium tertium Se on soikea, ei deformoi bacillusta ja se sijaitsee terminaalitasolla.
- Endospore Clostridium tetani se on terminaalinen ja deformoi bacilluksen, mikä antaa rummun ulkonäön.
- Itiöt Clostridium botulinum, C. histolyticum, C. Novy ja C. septicum ne ovat pyöreitä tai subterminaalisia ovaalisia ja deformoivat bacilluksen.
- Endospore Clostridium sordelli se sijaitsee keskiasennossa, jossa on hieman muodonmuutoksia.

viittaukset
- Hayama M, Oana K, Kozakai T, Umeda S, Fujimoto J, Ota H, Kawakami Y. Ehdotus yksinkertaistetusta tekniikasta bakteerien itiöiden värjäämiseksi ilman, että Moellerin menetelmää muutettiin lämpöä onnistuneesti. Eur J Med Res. 2007; 16 12 (8): 356-9.
- Wikipedia-avustajat. Moeller tahraa. Wikipedia, The Free Encyclopedia. 3. marraskuuta 2018, 03:28 UTC. Saatavilla osoitteessa: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). Mikrobiologisten menetelmien laboratoriokäsikirja. Perustieteiden laitos Mikrobiologian akatemia. Kansallinen ammattikorkeakoulu.
- "Sisäitiöitä." Wikipedia, vapaa tietosanakirja. 25. helmikuuta 2018, 10:20 UTC. 10.1.2019, 02:42: en.wikipedia.org
- Silva L, Silva C, Fernández N, Bueno C, Torres J, Rico M, Macías J ja yhteistyökumppanit. (2006). Extremaduran autonomisen yhteisön työvoimahenkilöstö. Erityisohjelma IV osa. Toimituksellinen MAD. Sevilla-Espanja, s. 211-212.
- Silva M, García M, Corrales J, Ponce E. (2006), Galician terveyspalvelun (SERGAS) erikoislääkäri. Aiheen määrä 2. Toimituksellinen MAD. Sevilla-Espanja, s. 79-80.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologinen diagnoosi. (5. painos). Argentiina, toimittaja Panamericana S.A..
- Forbes B, Sahm D, Weissfeld A. 2009. Bailey & Scottin mikrobiologinen diagnoosi. 12 toim. Argentiinassa. Panamericana S.A Toimituksellinen


