Orgaaniset suolat fysikaaliset ja kemialliset ominaisuudet, käyttötavat ja esimerkit
orgaaniset suolat ne ovat tiheä määrä ionisia yhdisteitä, joilla on lukemattomat ominaisuudet. Ne johdetaan aikaisemmin orgaanisesta yhdisteestä, joka on läpikäynyt transformaation, joka sallii sen olla varauksen kantaja, ja myös sen kemiallinen identiteetti riippuu siihen liittyvästä ionista.
Alla olevassa kuvassa esitetään kaksi hyvin yleistä kemiallista kaavaa orgaanisia suoloja varten. Ensimmäinen, R-AX, tulkitaan yhdisteeksi, jonka hiilirakenteessa atomi tai ryhmä A sisältää positiivisen varauksen + tai negatiivisen (-).
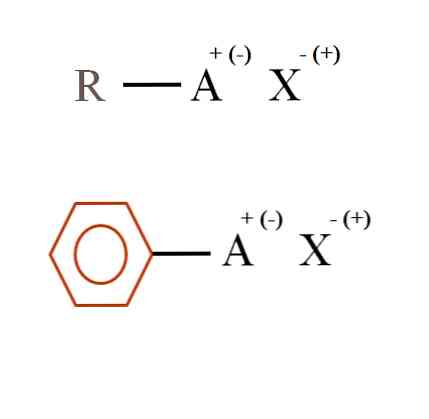
Kuten voidaan nähdä, R: n ja A: n, R-A: n välillä on kovalenttinen sidos, mutta A: lla on puolestaan muodollinen varaus, joka houkuttelee (tai torjuu) X-ionin. Maksun merkki riippuu A: n luonteesta ja kemiallisesta ympäristöstä.
Jos A olisi positiivinen, kuinka monta X voisi olla vuorovaikutuksessa? Vain yhden kanssa, kun otetaan huomioon sähköoneutraalisuuden periaate (+ 1-1 = 0). Mikä on kuitenkin X: n identiteetti? Anioni X voisi olla CO32-, vaatii kaksi kationia RA+; halogenidi: F-, cl-, br-, jne.; tai jopa toinen RA-yhdiste-. Vaihtoehdot ovat arvaamattomia.
Orgaanisella suolalla voi myös olla aromaattinen luonne, joka on esitetty ruskeassa bentseenirenkaassa. Kuparibentsoaattisuola (II), (C6H5COO)2Cu koostuu esimerkiksi kahdesta aromaattisesta renkaasta, joissa on negatiivisesti varautuneita karboksyyliryhmiä, jotka ovat vuorovaikutuksessa kationin kanssa.2+.
indeksi
- 1 Fysikaaliset ja kemialliset ominaisuudet
- 1.1 Suuret molekyylipainot
- 1.2 Amfifiilit ja pinta-aktiiviset aineet
- 1.3 Korkea kiehumis- tai sulamispiste
- 1.4 Happamuus ja emäksisyys
- 2 Käyttö
- 3 Esimerkkejä orgaanisista suoloista
- 3.1 Karboksylaatit
- 3.2 Litiumdiakryyliprudaatit
- 3.3 Sulfoniumin suolat
- 3.4 Oxoniumin suolat
- 3.5 Amiinisuolat
- 3.6 Diatsoniumisuolat
- 4 Viitteet
Fysikaaliset ja kemialliset ominaisuudet
Kuvasta voidaan todeta, että orgaaniset suolat koostuvat kolmesta komponentista: orgaanisesta, R: stä tai Ar: sta (aromaattinen rengas), atomista tai ryhmästä, jossa on ioninen varaus A, ja vastaionia X.
Aivan kuten kemiallinen identiteetti ja rakenne määritellään tällaisilla komponenteilla, joten niiden ominaisuudet riippuvat niistä.
Tästä voidaan tiivistää tiettyjä yleisiä ominaisuuksia, jotka täyttävät valtaosan näistä suoloista.
Suuret molekyylipainot
Kun oletetaan, että mono- tai moniarvoiset epäorgaaniset X-anionit, orgaanisilla suoloilla on tavallisesti paljon suurempia molekyylipainoja kuin epäorgaaniset suolat. Tämä johtuu pääasiassa hiilen luurankosta, jonka yksinkertaiset C-C-sidokset ja niiden vetyatomit vaikuttavat paljon massaan yhdisteeseen.
Siksi ne ovat R- tai Ar-vastuussa niiden suurista molekyylipainoista.
Amfifiilit ja pinta-aktiiviset aineet
Orgaaniset suolat ovat amfifiilisiä yhdisteitä, toisin sanoen niiden rakenteilla on sekä hydrofiilisiä että hydrofobisia päät.
Mitkä ovat tällaisia ääripäitä? R tai Ar edustavat hydrofobista päätä, koska niiden C- ja H-atomeilla ei ole suurta affiniteettia vesimolekyyleihin.
+(-), varausta kantava atomi tai ryhmä on hydrofiilinen pää, koska se edistää dipolaarista hetkeä ja vuorovaikutuksessa veden muodostavien dipolien kanssa (RA+ OH2).
Kun hydrofiiliset ja hydrofobiset alueet on polarisoitu, amfifiilinen suola muuttuu pinta-aktiiviseksi aineeksi, aineeksi, jota käytetään laajasti pesuaineiden valmistukseen ja emulsionhajotusaineina.
Korkea kiehumis- tai sulamispiste
Epäorgaanisten suolojen tavoin orgaanisilla suoloilla on myös korkeat sulamis- ja kiehumispisteet johtuen nestemäisessä tai kiinteässä faasissa vallitsevista sähköstaattisista voimista..
Kuitenkin, jossa on orgaaninen komponentti R tai Ar, muun tyyppisiä Van der Waalsin voimia (Lontoon voimat, dipoli-dipoli, vedyn sillat), jotka kilpailevat tietyllä tavalla sähköstaattisilla.
Tästä syystä orgaanisten suolojen kiinteät tai nestemäiset rakenteet ovat ensinnäkin monimutkaisempia ja vaihtelevampia. Jotkut heistä voivat jopa käyttäytyä nestekiteet.
Happamuus ja emäksisyys
Orgaaniset suolat ovat tavallisesti vahvempia happoja tai emäksiä kuin epäorgaanisia suoloja. Tämä johtuu siitä, että A: lla, esimerkiksi amiinisuoloissa, on positiivinen varaus johtuen sen sidoksesta ylimääräiseen vetyyn: A+-H. Antakaa sitten kosketuksessa alustan kanssa protoni palamaan neutraaliksi yhdisteeksi:
RA+H + B => RA + HB
H kuuluu A: lle, mutta se on kirjoitettu, koska se vaikuttaa neutralointireaktioon.
Toisaalta RA+ se voi olla suuri molekyyli, joka ei kykene muodostamaan kiinteitä aineita kiteisellä verkolla, joka on riittävän stabiili hydroksyylianionin tai hydroksyyli-OH: n kanssa-.
Kun näin on, suola RA+OH- se käyttäytyy kuin vahva pohja; jopa emäksinen kuin NaOH tai KOH:
RA+OH- + HCI => RACl + H2O
Huomaa, että Cl-anioni on kemiallinen yhtälö- se korvaa OH: n-, muodostavat suolan RA+cl-.
sovellukset
Orgaanisten suolojen käyttö vaihtelee R: n, Ar: n, A: n ja X: n identiteetin mukaan. Lisäksi sovellus, johon ne on tarkoitettu, riippuu myös niiden muodostaman kiinteän aineen tai nesteen tyypistä. Tässä yhteydessä on joitakin yleisiä seikkoja:
-Ne toimivat reagensseina muiden orgaanisten yhdisteiden synteesille. RAX voi toimia R-ketjun "luovuttajana", joka lisätään toiseen yhdisteeseen, joka korvaa hyvän lähtevän ryhmän.
-Ne ovat pinta-aktiivisia aineita, joten niitä voidaan käyttää myös voiteluaineina. Tähän tarkoitukseen käytetään karboksylaattien metallisuoloja.
-Niiden avulla voidaan syntetisoida laaja valikoima väriaineita.
Esimerkkejä orgaanisista suoloista
karboksylaatit
Karboksyylihapot reagoivat hydroksidin kanssa neutralointireaktiossa, jolloin syntyy karboksylaattien suoloja: RCOO- M+; missä M+ Se voi olla mikä tahansa metallikationi (Na+, pb2+, K+, jne.) tai NH-ammoniumkationia4+.
Rasvahapot ovat pitkäketjuisia alifaattisia karboksyylihappoja, ne voivat olla tyydyttyneitä ja tyydyttymättömiä. Palmitiinihappo (CH) on tyydyttyneiden3(CH2)14COOH). Tämä on peräisin palmitaattisuolasta, kun taas steariinihappo (CH3(CH2)16COOH muodostaa stearaattisuolan. Saippuat koostuvat näistä suoloista.
Bentsoehapon tapauksessa C6H5COOH (jossa C6H5- se on bentseenirengas), kun se reagoi emäksen kanssa muodostaa bentsoaattisuolat. Kaikissa karboksylaateissa -COO-ryhmä- edustaa A (RAX).
Litiumdiakupupraatit
Litiumdiakuprate on käyttökelpoinen orgaanisessa synteesissä. Sen kaava on [R-Cu-R]-li+, jossa kupariatomi sisältää negatiivisen varauksen. Tässä kupari edustaa kuvan atomia A.
Sulfoniumsuolat
Ne muodostetaan orgaanisen sulfidin reaktiosta alkyylihalidin kanssa:
R2S + R'X => R2R'S+X
Näille suoloille rikkiatomi sisältää positiivisen muodollisen varauksen (S+) jossa on kolme kovalenttista sidosta.
Oxonium-suolat
Eetterit (sulfidien hapetetut analogit) reagoivat myös hydroksidien kanssa oksonisuolojen muodostamiseksi:
ROR '+ HBr <=> RO+HR '+ Br-
HBr: n happo-protoni on sitoutunut kovalenttisesti eetterin happiatomiin (R2O+-H), lataamalla se positiivisesti.
Amiinisuolat
Amiinit voivat olla primaarisia, sekundaarisia, tertiäärisiä tai kvaternaarisia sekä niiden suoloja. Kaikille niille on tunnusomaista, että sillä on H-atomi, joka on kytketty typpiatomiin.
Niin, RNH3+X- se on primaarinen amiinisuola; R2NH2+X-, sekundaarisesta amiinista; R3NH+X-, tertiäärisestä amiinista; ja R4N+X-, kvaternäärinen amiini (kvaternaarinen ammoniumsuola).
Diatsoniumsuolat
Lopuksi diatsoniumsuolat (RN2+X-) tai arildiatsonium (ArN)2+X-) edustavat monien orgaanisten yhdisteiden, erityisesti atsoväriaineiden, lähtökohtaa.
viittaukset
- Francis A. Carey. Orgaaninen kemia (Kuudes painos., S. 604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Orgaaninen kemia. Amiineja. (10. painos.). Wiley Plus.
- Wikipedia. (2018). Suola (kemia). Otettu: en.wikipedia.org
- Steven A. Hardinger. (2017). Kuvitettu orgaanisen kemian sanasto: suolat. Haettu osoitteesta: chem.ucla.edu
- Chevron Oronite. (2011). Karboksylaatteja. [PDF]. Haettu osoitteesta oronite.com


