Endotermiset reaktion ominaisuudet, yhtälöt ja esimerkit
endoterminen reaktio on se, joka on toteutettava energian absorboimiseksi lämmön tai säteilyn muodossa ympäristöstään. Yleensä, vaikkakaan ei aina, ne voidaan tunnistaa lämpötilan lasku niiden ympäristössä; tai päinvastoin, he tarvitsevat lämpölähteen, kuten palavan liekin.
Energian tai lämmön imeytyminen on sitä, mitä kaikilla endotermisillä reaktioilla on yhteisiä; Saman luonne ja muutokset ovat hyvin erilaisia. Kuinka paljon lämmön pitäisi imeä? Vastaus riippuu sen termodynamiikasta: lämpötilasta, jossa reaktio tapahtuu spontaanisti.

Esimerkiksi yksi symbolisimmista endotermisistä reaktioista on tilan vaihtuminen jäästä nestemäiseen veteen. Jään täytyy imeä lämpöä, kunnes sen lämpötila on noin 0 ºC; siinä lämpötilassa sen sulaminen muuttuu spontaaniksi ja jää imeytyy, kunnes se on täysin sulanut.
Kuumissa tiloissa, kuten rannan rannoilla, lämpötilat ovat korkeammat, joten jää absorboi lämpöä nopeammin; eli se sulaa suuremmalla nopeudella. Jäätiköiden sulaminen on esimerkki ei-toivotusta endotermisestä reaktiosta.
Miksi näin tapahtuu? Miksi jäätä ei esitetä kuumana kiinteänä aineena? Vastaus on molempien valtioiden vesimolekyylien keskimääräinen kineettinen energia ja miten ne vuorovaikutuksessa keskenään vetysidosten avulla.
Nestemäisessä vedessä sen molekyyleillä on suurempi liikkumisvapaus kuin jäässä, jossa ne värisevät kiinteästi kiteissään. Siirrettäväksi molekyylien täytyy absorboida energiaa siten, että niiden värähtelyt rikkovat jään voimakkaat suuntavetyletket.
Tästä syystä jää imee lämpöä sulamaan. Jotta "kuumaa jäätä" voitaisiin käyttää, vedyn siltojen olisi oltava epätavallisen voimakkaita sulamaan lämpötilassa, joka on selvästi yli 0 ° C..
indeksi
- 1 Endotermisen reaktion ominaisuudet
- 1,1 AH> 0
- 1.2 Jäähdytä ympäristöään
- 2 Yhtälöt
- 3 Esimerkkejä tavallisista endotermisistä reaktioista
- 3.1 Kuivan jään haihtuminen
- 3.2 Leipien leivonta tai ruoanlaitto
- 3.3 Auringonotto
- 3.4 Ilmakehän typen ja otsonin muodostumisen reaktio
- 3.5 Veden elektrolyysi
- 3.6 Fotosynteesi
- 3.7 Joidenkin suolojen liuokset
- 3.8 Lämpökatkot
- 3.9 Ammoniumkloridi vedessä
- 3.10 Natriumtriosulfaatti
- 3.11 Auton moottorit
- 3.12 kiehuvat nesteet
- 3.13 Munan valmistaminen
- 3.14 Ruoanlaitto
- 3.15 Ruuan lämmittäminen mikroaaltouunissa
- 3.16 Lasin muovaus
- 3.17 Kynttilän kulutus
- 3.18 Puhdistus kuumalla vedellä
- 3.19 Elintarvikkeiden ja muiden esineiden lämpösterilointi
- 3.20 Infektioiden torjunta kuumetta vastaan
- 3.21 Veden haihtuminen
- 4 Viitteet
Endotermisen reaktion ominaisuudet
Tilanmuutos ei ole asianmukaisesti kemiallinen reaktio; sama asia tapahtuu kuitenkin: tuotteella (nestemäinen vesi) on enemmän energiaa kuin reaktantti (jää). Tämä on reaktion tai endotermisen prosessin pääominaisuus: tuotteet ovat energisempiä kuin reagenssit.
Vaikka tämä on totta, se ei tarkoita, että tuotteiden on oltava epävakaita. Siinä tapauksessa, että se on, endoterminen reaktio lakkaa olemasta spontaani kaikissa lämpötilan tai paineen olosuhteissa.
Harkitse seuraavaa kemiallista yhtälöä:
A + Q => B
Kun Q edustaa lämpöä, joka ilmaistaan yleensä joule (J): n yksikköinä tai kaloreina (cal). Koska A absorboi lämmön Q transformoidakseen B: ksi, sanotaan, että se on endoterminen reaktio. Siten B: llä on enemmän energiaa kuin A, ja sen täytyy absorboida riittävästi energiaa sen muuntamisen saavuttamiseksi.
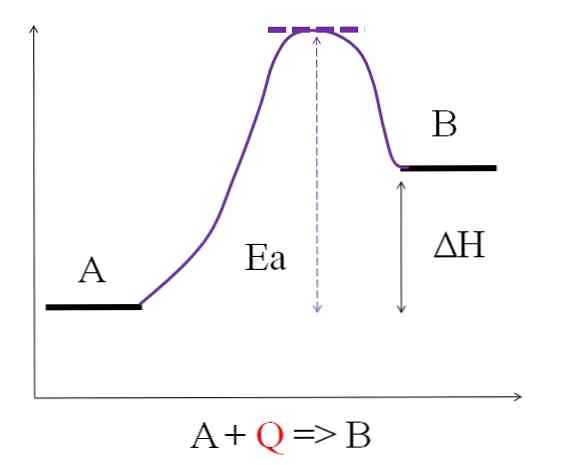
Kuten edellä olevasta kaaviosta voidaan nähdä, A: lla on vähemmän energiaa kuin B. A: ta absorboiva lämmön määrä Q on sellainen, että se voittaa aktivointienergian (energia, joka tarvitaan purppuran kattoon purppuran ylittämiseen). Energian ero A: n ja B: n välillä on se, joka tunnetaan reaktion entalpiana, AH.
AH> 0
Kaikilla endotermisillä reaktioilla on yhteinen edellinen kaavio, koska tuotteet ovat energisempiä kuin reagenssit. Siksi niiden välinen energiaero, AH, on aina positiivinen (Htuote-Hreagenssin > 0). Kun tämä on totta, lämmön tai energian imeytyminen ympäristöstä on välttämätöntä tämän energisen tarpeen saamiseksi.
Ja miten tällaisia ilmaisuja tulkitaan? Kemiallisissa reaktioissa linkit ovat aina rikki muiden luomiseen. Niiden rikkomiseksi tarvitaan energian imeytymistä; se on endoterminen kulku. Samaan aikaan linkkien muodostuminen merkitsee vakautta, joten se on eksoterminen askel.
Kun muodostuneet sidokset eivät tuota vakautta, joka on verrattavissa vanhan sidoksen katkaisemiseen tarvittavaan energiamäärään, tämä on endoterminen reaktio. Siksi tarvitaan lisää energiaa, jotta edistetään reagenssien stabiilimpien sidosten rikkoutumista.
Toisaalta eksotermisissä reaktioissa tapahtuu päinvastainen: lämpö vapautuu ja AH on < 1 (negativo). Aquí los productos son más estables que los reactivos, y el diagrama entre A y B cambia de forma; ahora B se ubica por debajo de A, y la energía de activación es menor.
He viilentävät ympäristöään
Vaikka se ei koske kaikkia endotermisiä reaktioita, useat niistä aiheuttavat ympäristön lämpötilan laskun. Tämä johtuu siitä, että imeytynyt lämpö tulee jostain. Näin ollen, jos A: n ja B: n muuntaminen kuljetettiin astiaan, se jäähtyy.
Enemmän endotermistä reaktiota, kylmempi säiliö ja sen ympäristö muuttuvat. Itse asiassa jotkut reaktiot voivat jopa muodostaa ohuen jääpeitteen, ikään kuin ne olisivat tulleet ulos jääkaapista.
On kuitenkin olemassa tällaisia reaktioita, jotka eivät viileä ympäristöään. Miksi? Koska ympäristön lämpö on riittämätön; eli se ei anna tarvittavaa Q (J, cal), joka on kirjoitettu kemiallisissa yhtälöissä. Siksi se on täällä, kun tulipalo tai ultraviolettisäteily tulee.
Molempien skenaarioiden välillä voi syntyä pieni sekavuus. Toisaalta ympäristön lämpö riittää reaktion etenemiseen spontaanisti, ja jäähdytystä havaitaan; ja toisaalta tarvitaan enemmän lämpöä ja käytetään tehokasta lämmitysmenetelmää. Molemmissa tapauksissa tapahtuu sama asia: energia imeytyy.
yhtälöt
Mitkä ovat yhtälöt endotermisessä reaktiossa? Kuten jo on selitetty, AH: n on oltava positiivinen. Voit laskea sen seuraavana kemiallisena yhtälönä:
aA + bB => cC + dD
Kun A ja B ovat reagoivia aineita, ja C ja D ovat tuotteita. Pienet kirjaimet (a, b, c ja d) ovat stoikiometrisiä kertoimia. Tämän yleisen reaktion AH laskemiseksi käytetään seuraavaa matemaattista ilmaisua:
.DELTA.Htuottaa- .DELTA.Hreagenssit = AHreaktioajan
Voit edetä suoraan tai tehdä laskelmat erikseen. ΔH: lletuottaa seuraava summa on laskettava:
c ΔHFC + dAHFD
Missä ΔHF se on kunkin reaktioon osallistuvan aineen muodostumisen entalpia. Yleisesti ottaen niiden vakaimpien muotojen aineilla on AHF= 0 Esimerkiksi O-molekyylit2 ja H2, tai kiinteällä metallilla, niillä on AHF= 0.
Sama laskelma tehdään nyt myös reagensseille, AHreagenssit:
arvoon AHFA + b AHFB
Mutta kuten yhtälöstä sanotaan ΔHreagenssit on vähennettävä AH: statuottaa, sitten edellinen summa on kerrottava -1: llä. Joten sinulla on:
c ΔHFC + dAHFD - (ΔHFA + b AHFB)
Jos tämän laskennan tulos on positiivinen luku, niin se on endoterminen reaktio. Ja jos se on negatiivinen, se on eksoterminen reaktio.
Esimerkkejä tavallisista endotermisistä reaktioista
Kuivan jään haihtuminen

Jokainen, joka on nähnyt jäätelökärrystä peräisin olevat valkoiset höyryt, on nähnyt yhden yleisimmistä esimerkeistä endotermisestä "reaktiosta"..
Muutaman jäätelön lisäksi nämä höyryt, jotka ovat irronneet kiinteästä valkoisesta, eli kuivajää, ovat myös olleet osa skenaarioita, jotka aiheuttivat sumun vaikutuksen. Tämä kuiva jää on vain kiinteä hiilidioksidi, joka absorboi lämpötilan ja ennen kuin ulkoinen paine alkaa sublimoitua.
Lasten yleisön kokeilu olisi täyttää ja sinetöidä pussi kuivalla jäällä. Hetken kuluttua se päätyy täyttymään CO: n takia2 kaasumainen, joka tuottaa työtä tai painaa pussin sisäseinät ilmakehän paineeseen.
Leivonnaiset tai ruoanlaitto

Leipien leivonta on esimerkki kemiallisesta reaktiosta, sillä nyt on olemassa kuumia aiheuttavia kemiallisia muutoksia. Joka tuoksuu tuoreen leivän leivistä, tiedetään, että tapahtuu endoterminen reaktio.
Taikina ja kaikki sen ainesosat tarvitsevat uunin lämpöä suorittamaan kaikki muutokset, jotka ovat välttämättömiä leiväksi ja näyttävät tyypilliset ominaisuudet.
Leivän lisäksi keittiö on täynnä esimerkkejä endotermisistä reaktioista. Kuka kokki käsittelee heitä päivittäin. Ruoanlaitto, jyvien pehmentäminen, maissinjyvien lämmittäminen, leivonta-munat, maustekiirteet, kakun paistaminen, teetä, voileipien lämmitys; kukin näistä toiminnoista on endotermisiä reaktioita.
aurinkoa

Aivan niin yksinkertaisia ja yleisiä kuin ne saattavat tuntua, aurinkoa, jota tietyt matelijat ottavat, kuten kilpikonnat ja krokotiilit, kuuluvat endotermisten reaktioiden luokkaan. Kilpikonnat imevät auringon lämpöä säätelemään organisminsa lämpötilaa.
Ilman aurinkoa he pitävät veden lämpöä lämpimänä; mikä päätyy jäähdyttämään säiliöiden tai kalasäiliöiden vettä.
Ilmakehän typen ja otsonin muodostumisen reaktio

Ilma koostuu pääasiassa typestä ja hapesta. Ukkosmyrskyjen aikana vapautuu energia, joka voi rikkoa voimakkaat sidokset, jotka pitävät typpiatomeja yhdessä N-molekyylissä.2:
N2 + O2 + Q => 2NO
Toisaalta happi voi imeä ultraviolettisäteilyä otsoniksi; hapen allotrooppi, joka on erittäin hyödyllinen stratosfäärissä, mutta vahingoittaa elämää maanpinnan tasolla. Reaktio on:
3O2 + v => 2O3
Missä v tarkoittaa ultraviolettisäteilyä. Tämän yksinkertaisen yhtälön takana oleva mekanismi on hyvin monimutkainen.
Veden elektrolyysi
Elektrolyysi käyttää sähköenergiaa molekyylin erottamiseksi sen elementeistä tai molekyylien muodostamisesta. Esimerkiksi veden elektrolyysissä syntyy kaksi kaasua: vety ja happi, kukin eri elektrodeissa:
2H2O => 2H2 + O2
Myös natriumkloridilla voi olla sama reaktio:
2NaCl => 2Na + Cl2
Yhdessä elektrodissa näkyy metallisen natriumin muodostuminen ja muissa vihertävissä kloorin kuplia.
fotosynteesi

Kasvien ja puiden täytyy absorboida auringonvaloa energiansaantina syntetisoimalla niiden biomateriaaleja. Tätä varten se käyttää CO: ta raaka-aineena2 ja vesi, joka pitkien vaiheiden avulla muunnetaan glukoosiksi ja muiksi sokereiksi. Lisäksi muodostuu happea, joka vapautuu lehdistä.
Joidenkin suolojen liuokset
Jos natriumkloridia liuotetaan veteen, astian tai säiliön ulkoisessa lämpötilassa ei havaita merkittävää muutosta..
Jotkut suolat, kuten kalsiumkloridi, CaCl2, lisätä veden lämpötilaa Ca-ionien suuren hydratoitumisen tuloksena2+. Ja muut suolat, kuten nitraatti tai ammoniumkloridi, NH4NO3 ja NH4Cl, vähennä veden lämpötilaa ja jäähdytä sen ympäristö.
Luokkahuoneissa tehdään yleensä kotitekoisia kokeita, jotka liuottavat joitakin näistä suoloista osoittamaan, mikä on endoterminen reaktio.
Lämpötilan lasku johtuu NH-ionien hydraatiosta4+ se ei suosi sen suolojen kiteisten järjestelyjen liukenemista vastaan. Siten suolat absorboivat lämpöä vedestä, jotta ionit voidaan solvatoitua.
Toinen kemiallinen reaktio, joka on yleensä hyvin yleinen tämän osoittamiseksi, on seuraava:
Ba (OH)2· 8H2O + 2NH4NO3 => Ba (NO3)2 + 2NH3 +10H2O
Huomaa muodostuneen veden määrä. Sekoittamalla molemmat kiinteät aineet saadaan vesipitoinen Ba-liuos (NO3)2, jossa on ammoniakin haju ja sellainen lämpötilan lasku, joka kirjaimellisesti jäädyttää säiliön ulkopinnan.
Termiset hajoamiset
Yksi yleisimmistä termisen hajoamisen muodoista on natriumbikarbonaatti, NaHCO3, tuottaa CO2 ja vettä kuumennettaessa. Monet kiinteät aineet, mukaan lukien karbonaatit, pyrkivät hajottamaan CO: n vapauttamiseksi2 ja vastaava oksidi. Kalsiumkarbonaatin hajoaminen on esimerkiksi seuraava:
CaCO3 + Q => CaO + CO2
Sama koskee magnesiumia, strontiumia ja bariumkarbonaatteja.
On tärkeää huomata, että terminen hajoaminen eroaa palamisesta. Ensimmäisessä ei ole syttymistä tai lämpöä vapautuu, kun taas toisessa kyllä; toisin sanoen palaminen on eksoterminen reaktio, vaikka se tarvitsee alun perin lämpöä, joka tapahtuu tai tapahtuu spontaanisti.
Ammoniumkloridi vedessä
Kun pieni määrä ammoniumkloridia (NH4Cl) liuotetaan veteen koeputkessa, putki jäähtyy aikaisemmin. Tämän kemiallisen reaktion aikana lämpö imeytyy ympäristöstä.
Natriumtriosulfaatti
Kun natriumtiosulfaatti kiteet (Na2S2O3.5H2O), joka yleisesti kutsutaan hypo-aineeksi, liukenee veteen, tapahtuu jäähdytysvaikutus.
Auton moottorit
Bensiinin tai dieselin polttaminen autojen, kuorma-autojen, traktoreiden ja linja-autojen moottoreissa tuottaa mekaanista energiaa, jota käytetään näiden ajoneuvojen liikkeessä.
Kiehuvat nesteet
Laittamalla neste lämpöön, se saa energiaa ja menee kaasumaiseen tilaan.
Keittäminen muna
Kun lämpöä käytetään, muna-proteiinit denaturoidaan muodostaen kiinteän rakenteen, joka tavallisesti nautitaan.
Ruoanlaitto
Yleisesti ottaen aina kun lämpöä keitetään ruoan ominaisuuksien muuttamiseksi, esiintyy endotermisiä reaktioita.
Nämä reaktiot johtavat siihen, että ruoka muuttuu pehmeämmäksi, synnyttää muokattavia massoja, vapauttaa niiden sisältämät komponentit.
Lämmitys ruoka mikroaaltouunissa
Mikroaaltosäteilyllä ruoassa olevat vesimolekyylit absorboivat energiaa, alkavat värisemään ja lisäämään ruokaa.
Valettu lasi
Lasi-lämmön imeytyminen tekee niiden liitoksista joustavammat, jolloin niiden muoto muuttuu helpommin.
Kynttilän kulutus
Kynttilävaha sulaa, koska se absorboi liekin lämpöä ja muuttaa sen muotoa.
Puhdistus kuumalla vedellä
Kun käytät kuumaa vettä rasvalla värjättyjen esineiden, kuten kattiloiden tai vaatteiden, puhdistamiseen, rasva tulee nestemäisemmäksi ja on helpompi poistaa.
Elintarvikkeiden ja muiden esineiden lämpösterilointi
Kun kuumennetaan esineitä tai ruokaa, niiden sisältämät mikro-organismit lisäävät myös niiden lämpötilaa.
Kun paljon lämpöä syötetään, tapahtuu reaktioita mikrobisolujen sisällä. Monet näistä reaktioista, kuten katkeamiskytkennät tai proteiinin denaturaatio, lopulta tappavat mikro-organismeja.
Infektioiden torjunta kuumetta vastaan
Kun kuume ilmenee, se johtuu siitä, että keho tuottaa tarvittavan lämmön tappamaan infektioita aiheuttavia ja sairauksia aiheuttavia bakteereita ja viruksia.
Jos syntynyt lämpö on korkea ja kuume on korkea, myös kehon solut vaikuttavat kuolemaan.
Veden haihtuminen
Kun vesi haihtuu ja muuttuu höyryksi, se johtuu lämmöstä, joka se saa ympäristöstä. Koska jokainen vesimolekyyli vastaanottaa lämpöenergiaa, sen värähtelyenergia nousee siihen pisteeseen, jossa se voi liikkua vapaasti, jolloin syntyy höyryä.
viittaukset
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. painos). CENGAGE Learning.
- Wikipedia. (2018). Endoterminen prosessi. Haettu osoitteesta: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (27. joulukuuta 2018). Endotermisen reaktion esimerkit. Haettu osoitteesta thinkco.com
- Khan Academy. (2019). Endoterminen vs. eksotermiset reaktiot Haettu osoitteesta: khanacademy.org
- Serm Murmson. (2019). Mitä tapahtuu molekyylitasolla endotermisen reaktion aikana? Hearst Seattle Media. Haettu osoitteesta education.seattlepi.com
- QuimiTube. (2013). Reaktion entalpian laskeminen muodostumisen entalpioista. Haettu osoitteesta: quimitube.com
- Quimicas.net (2018). Esimerkkejä endotermisestä reaktiosta. Haettu osoitteesta:
quimicas.net.


