Mikä on neutraali atomi? (Esimerkkejä)
neutraali atomi se on se, jolla ei ole sähkövarausta sen protonien ja elektronien määrän välisen kompensoinnin vuoksi. Molemmat ovat sähköisesti varautuneita subatomisia hiukkasia.
Protonit agglomeroituvat neutronien viereen ja muodostavat ytimen; kun elektronit hajaantuvat määrittelemällä sähköinen pilvi. Kun protonien lukumäärä atomissa, joka on sen atomiluku (Z), on yhtä suuri kuin elektronien lukumäärä, sanotaan, että atomin sisällä olevien sähkövarausmaksujen välillä on korvaus.
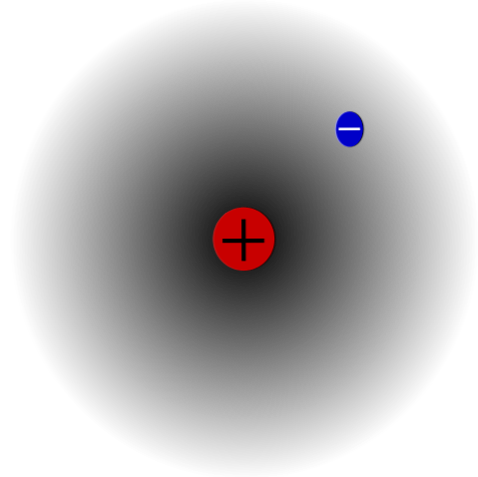
Esimerkiksi on vetyatomi (ylempi kuva), jossa on protoni ja elektroni. Protoni on sijoitettu atomin keskelle sen ytimeksi, kun taas elektroni kiertää ympäröivää tilaa ja jättää alemmat elektronitiheyden alueet siirtyessään pois ytimestä.
Tämä on neutraali atomi, koska on totta, että Z on yhtä suuri kuin elektronien lukumäärä (1p = 1e). Jos H-atomit menettäisivät tämän yksittäisen protonin, atomiradio kutistuisi ja protonin lataus olisi vallitseva, jolloin siitä tulee H-kationi.+ (Hydron). Jos toisaalta se saa elektronin, olisi kaksi elektronia ja siitä tulisi H-anioni-- (Hydridi).
indeksi
- 1 Neutraali atomi ja ioni
- 1,1 Na ja Na+
- 2 neutraalia molekyyliä
- 3 Esimerkkejä
- 3.1 Happi
- 3.2 Kupari
- 3.3 Jalokaasut
- 3.4 Metalliseokset
- 4 Viitteet
Neutraali atomi suhteessa ioniin
H: n neutraalin atomin esimerkissä havaittiin, että protonien määrä on yhtä suuri kuin elektronien lukumäärä (1p = 1e); tilannetta, jota ei esiinny ionien johdosta elektronin menetys tai hyöty.
Ionit muodostuvat elektronien määrän muutoksesta joko siksi, että atomi voittaa ne (-) tai menettää ne (+).
Kationin H atomissa+ Yksittäisen protonin valenssimaksu on vallitseva elektronin täydellisen poissaolon edessä (1p> 0e). Tämä pätee kaikkiin muihin jaksollisen taulukon raskaampiin atomeihin (np> ne).
Vaikka positiivisen varauksen läsnäolo saattaa tuntua merkityksettömältä, se muuttuu diagonaalisesti kyseisen elementin ominaisuuksiin.
Toisaalta anioniatomissa H- Kahden elektronin negatiivinen varaus vallitsee yhden ytimen protonin edessä (1p<2e). Igualmente, los demás aniones de mayor masa tienen un exceso de electrones en comparación al número de protones (np
Na vs Na+
Parempi tunnettu esimerkki on metallisen natriumin esimerkki. Sen neutraali atomi, Na, jossa Z = 11, on 11 protonia; siksi on oltava 11 elektronia positiivisten varausten kompensoimiseksi (11p = 11e).
Natrium, joka on metallielementti, erittäin elektropositiivinen, menettää helposti elektroninsa; tässä tapauksessa hän menettää vain yhden valenssikuorensa (11p> 10e). Näin muodostuu Na-kationi+, joka vuorovaikutuksessa sähköstaattisesti anionin kanssa; kuten kloridi, Cl-, suolan natriumkloridissa, NaCl: ssa.
Metallinen natrium on myrkyllistä ja syövyttävää, kun taas sen kationi on jopa läsnä solujen sisällä. Tämä osoittaa, kuinka elementin ominaisuudet voivat vaihdella voimakkaasti, kun ne saavat tai menettää elektroneja.
Toisaalta Na-anioni- (soduro, hypoteettisesti) ei ole olemassa; ja voidakseen muodostaa, se olisi äärimmäisen reaktiivinen, koska natriumin kemiallista luonnetta vastaan on saada aikaan elektroneja. Na- sillä olisi 12 elektronia, jotka ylittävät sen ytimen positiivisen varauksen (11p<12e).
Neutraalit molekyylit
Atomit yhdistetään kovalenttisesti molekyylien synnyttämiseksi, joita voidaan kutsua myös yhdisteiksi. Molekyylissä ei voi olla eristettyjä ioneja; sen sijaan on atomeja, joilla on positiivisia tai negatiivisia virallisia maksuja. Nämä varatut atomit vaikuttavat molekyylin nettovaraan, joka muuntaa sen polyatomiseksi ioniksi.
Jotta molekyyli olisi neutraali, sen atomien virallisten varausten summa on oltava yhtä suuri kuin nolla; tai yksinkertaisesti kaikki sen atomit ovat neutraaleja. Jos molekyylin muodostavat atomit ovat neutraaleja, myös tämä on.
Esimerkiksi sinulla on vesimolekyyli, H2O. Sen kaksi H-atomia ovat neutraaleja, kuten happiatomi. Niitä ei voida esittää samalla tavalla kuin vetyatomin kuvassa; koska ydin ei muutu, sähköinen pilvi toimii.
Hydroniumioni, H3O+, Toisaalta sillä on happeaatomi, jolla on osittainen positiivinen varaus. Tämä tarkoittaa, että siinä polyatomisessa ionissa se menettää elektronin, ja siksi sen protonien määrä on suurempi kuin sen elektronien määrä..
esimerkit
happi
Neutraalilla happiatomilla on 8 protonia ja 8 elektronia. Kun se saa kaksi elektronia, se muodostaa anionioksidin, OR2-. Siinä vallitsevat negatiiviset varaukset, joilla on yli kaksi elektronia (8p<10e).
Neutraaleilla happiatomeilla on suuri taipumus reagoida ja sitoutua itsensä kanssa muodostaakseen O: n2. Tästä syystä ei ole atomeja tai "löysää" siellä kohtalolleen ja reagoimatta mihinkään. Kaikki tämän kaasun tunnetut reaktiot johtuvat molekyylistä happea, OR2.
kupari
Kuparissa on 29 protonia ja 29 elektronia (neutronien lisäksi). Toisin kuin happi, sen neutraalit atomit ovat luonteeltaan metalli- sidoksen ja suhteellisen vakauden vuoksi.
Natriumin tavoin se häviää elektroneja sen sijaan, että he voittaisivat. Elektronisen kokoonpanonsa ja muiden näkökohtiensa vuoksi se voi menettää yhden tai kaksi elektronia, joista tulee kupari kationeja, Cu+, tai kupari, Cu2+, vastaavasti.
Tiedonanto+ on yksi vähemmän elektronia (29p<28e), y el Cu2+ on menettänyt kaksi elektronia (29p<27e).
Jalokaasut
Jalokaasut (He, Ne, Ar, Kr, Xe, Rn) ovat yksi niistä harvoista elementeistä, jotka ovat neutraalien atomiensa muodossa. Niiden atomiluvut ovat: 2, 10, 18, 36, 54 ja 86. He eivät saa tai menettää elektroneja; vaikka Xenon, Xe, voi muodostaa yhdisteitä fluorin kanssa ja menettää elektroneja.
Metalliseokset
Metallit, jos ne on suojattu korroosiolta, voivat pitää neutraaleja atomejaan, jotka on yhdistetty metalli- sidoksiin. Seoksissa, metallien kiinteissä liuoksissa atomit pysyvät (enimmäkseen) neutraaleina. Esimerkiksi messingissä on Cu: n ja Zn: n neutraaleja atomeja.
viittaukset
- Jetser Carasco. (2016). Mikä on neutraali atomi? Haettu osoitteesta: Introduction-to-physics.com
- Merkinnät, Samuel. (25. huhtikuuta 2017). Ei neutraaleja atomien esimerkkejä. Sciencing. Haettu osoitteesta: sciencing.com
- Chem4Kids. (2018), tarkastellaan ioneja. Haettu osoitteesta: chem4kids.com
- Whitten, Davis, Peck & Stanley. (2008). Kemia. (8. painos). CENGAGE Learning.
- Shiver & Atkins. (2008). Epäorgaaninen kemia (Neljäs painos). Mc Graw Hill.


