Broglie Atomic Model Ominaisuudet ja rajoitukset
Broglie-atomimalli ehdotti Ranskan fyysikko Louis Broglie 1924 väitöskirjassaan, hän sanoi Broglien Aaltohiukkasdualismi elektronien ja loivat pohjan aalto mekaniikka. Broglie julkaistu tärkeä teoreettinen havainnot aalto-hiukkanen luonne asian atomitasolla.
De Broglie myöhemmin lausunnot kokeellisesti tiedemiehet Clinton Davisson ja Lester Germer 1927. aalto teoria electron de Broglie perustuu Einsteinin ehdotusta aallon ominaisuuksista valon lyhyitä aallonpituuksia.
Broglie ilmoitti mahdollisuudesta, että aineella oli samankaltainen käyttäytyminen kuin valossa, ja ehdotti samanlaisia ominaisuuksia subatomisissa hiukkasissa, kuten elektroneissa..
Sähköiset lataukset ja kiertoradat rajoittavat elektronien kuvaaman aallon amplitudia, pituutta ja taajuutta. Broglie selitti elektronien liikkumista atomin ytimen ympärillä.
indeksi
- 1 Broglie-atomimallin ominaisuudet
- 2 Davissonin ja Germerin kokeilu
- 3 Rajoitukset
- 4 Kiinnostavat artikkelit
- 5 Viitteet
Broglie-atomimallin ominaisuudet
Jotta hänen ehdotuksensa voitaisiin kehittää, Broglie aloitti periaatteesta, että elektronien kaksoisluonto oli aaltojen ja hiukkasten välillä, samankaltainen kuin valossa.
Siinä mielessä, Broglie verrannut nämä kaksi ilmiötä, ja joka perustuu yhtälöihin kehittämä Einstein tutkimukseen aallon luonne valo, todettiin:
- Fotonin kokonaisenergia ja siten myös elektronin kokonaisenergia saadaan aallon taajuuden ja laudan vakion tuloksesta (6.62606957 (29) × 10). -34 Jules x sekuntia), kuten seuraavassa ilmaisussa on kuvattu:
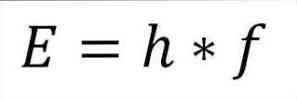
Tässä lausekkeessa:
E = elektronien energia.
h = lankku vakio.
f = aallon taajuus.
- Fotonin, ja siten elektronin, lineaarinen hetki on kääntäen verrannollinen aallonpituuteen, ja molemmat suuruudet ovat sidoksissa laudan vakiona:
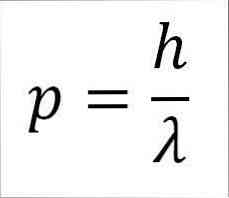
Tässä lausekkeessa:
p = elektronin lineaarinen hetki.
h = lankku vakio.
λ = aallonpituus.
- Lineaarinen momentti on partikkelin massan tuotto nopeudella, jonka hiukkanen on siirtymänsä aikana.
Jos edellinen matemaattinen lauseke järjestetään aallonpituuden funktiona, meillä on seuraavat:
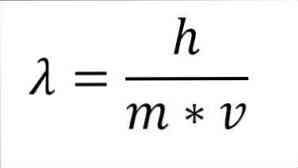
Mainitussa ilmaisussa:
λ = aallonpituus.
h = lankku vakio.
m = elektronin massa.
v = elektronin nopeus.
Koska h, Plank-vakio, on pieni arvo, myös aallonpituus λ on. Näin ollen on mahdollista todeta, että elektronin aallon ominaisuudet esiintyvät vain atomi- ja subatomisella tasolla.
- Broglie perustuu myös Bohrin atomimallin postulaatteihin. Jälkimmäisen mukaan elektronien kiertoradat ovat rajalliset ja voivat olla vain kokonaislukuja. näin:
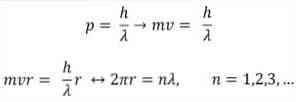
missä:
λ = aallonpituus.
h = lankku vakio.
m = elektronin massa.
v = elektronin nopeus.
r = kiertoradan säde.
n = kokonaisluku.
Mukaan Bohrin, joka Broglie hyväksytty perusteella, jos elektronit käyttäytyvät kuten seisovien aaltojen, ainoa sallittu kiertoradat ovat ne, joiden säde on yhtä suuri kuin kokonaisluku useita aallonpituus λ.
Siksi kaikki kiertoradat eivät täytä parametreja, joita tarvitaan elektronin liikkumiseen niiden läpi. Siksi elektronit voivat matkustaa vain tietyillä kiertoradoilla.
Broglie-elektronien aaltoteoria oikeutti Bohrin atomimallin onnistumisen selittämään vetyatomin yhden elektronin käyttäytymistä.
Vastaavasti se valaisee myös, miksi tämä malli ei sovi monimutkaisempiin järjestelmiin eli atomeihin, joissa on enemmän kuin yksi elektroni.
Davisson ja Germer kokeilevat
Broglie-atomimallin kokeellinen tarkastus tapahtui kolme vuotta sen julkaisemisen jälkeen vuonna 1927.
Tunnettuja amerikkalaisia fyysikkoja Clinton J. Davisson ja Lester Germer vahvistivat kokeellisesti aaltomekaniikan teoriaa.
Davisson ja Germer suorittivat elektronisuihkun sirontatestejä nikkelikiteen läpi ja havaitsivat diffraktioilmiön metalliväliaineen läpi.
Koe toteutettiin seuraavan menettelyn toteuttamisessa:
- Ensimmäisessä tapauksessa sijoitettiin elektronisuihkulaite, jolla oli tunnettu alkuenergia.
- Asennettiin jännitelähde elektronien liikkeen vauhdittamiseksi, mikä johti mahdolliseen eroon.
- Elektronisuihkun virtaus suunnattiin metallikiteitä kohti; tässä tapauksessa nikkeli.
- Mitattiin nikkelikiteisiin vaikuttavien elektronien lukumäärä.
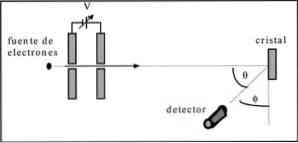
Kokeen lopussa Davisson ja Germer havaitsivat, että elektronit olivat hajallaan eri suuntiin.
Toistamalla kokeilu käyttäen eri suuntauksia olevia metallikiteitä tutkijat havaitsivat seuraavat:
- Elektronisuihkun dispersio metalli- kiteen läpi oli verrattavissa valonsäteiden häiriön ja diffraktion ilmiöön.
- Elektronien heijastus iskukristallissa kuvasi trajektoria, jonka teoriassa pitäisi kuvata Broglie-elektronien aaltojen teorian mukaan.
Synteesissä Davissonin ja Germerin kokeilu osoitti kokeellisesti elektronien kaksoisaaltohiukkasten luonteen.
rajoituksia
Broglie-atomimalli ei ennusta elektronin tarkkaa sijaintia kiertoradalla, jossa se liikkuu.
Tässä mallissa elektronit nähdään aaltoina, jotka liikkuvat kiertoradalla ilman tiettyä sijaintia, joka esittelee sähköisen kiertoradan käsitteen.
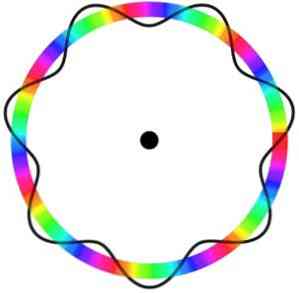
Lisäksi Broglie-atomimalli, joka on analoginen Schrödingerin mallin kanssa, ei pidä elektronien pyörimistä akselillaan (pyöräyttää).
Näiden subatomisten hiukkasten alueelliset variaatiot jätetään huomiotta jättämällä huomiotta elektronien sisäinen kulmamomentti..
Samassa järjestyksessä tässä mallissa ei oteta huomioon nopeiden elektronien käyttäytymisen muutoksia relativististen vaikutusten seurauksena.
Kiinnostavat artikkelit
Schrödingerin atomimalli.
Chadwickin atomi-malli.
Heisenbergin atomi-malli.
Perrinin atomi-malli.
Thomsonin atomimalli.
Daltonin atomimalli.
Dirac Jordanin atomimalli.
Demokraatin atomi-malli.
Bohrin atomi-malli.
viittaukset
- Bohrin kvanttiteoria ja De Broglie Waves (s.f.). Haettu osoitteesta ne.phys.kyushu-u.ac.j
- Louis de Broglie - Elämäkerta (1929). © Nobelin säätiö. Haettu osoitteesta: nobelprize.org
- Louis-Victor de Broglie (s.f.). Haettu osoitteesta chemed.chem.purdue.edu
- Lovett, B. (1998). Louis de Broglie. Encyclopædia Britannica, Inc. Haettu osoitteesta britannica.com
- De Broglie: n atomi-malli. Etäopetuksen kansallinen yliopisto. Espanjassa. Haettu osoitteesta: ocw.innova.uned.es
- Aallot Louis De Broglie (s.f.). Haettu osoitteesta: hiru.eus
- Von Pamel, O. ja Marchisio, S. (s.f.). Kvanttimekaniikka Rosarion kansallinen yliopisto. Haettu osoitteesta: fceia.unr.edu.ar


