Molekyylien geometriatyypit ja esimerkit
molekyylimuodossa tai molekyylirakenne on atomien avaruusjakauma keskiatomin ympärillä. Atomit edustavat alueita, joilla on korkea elektroninen tiheys, ja siksi niitä pidetään elektronisina ryhminä riippumatta siitä, mitä linkkejä se muodostaa (yhden, kahden tai kolmen hengen).
Tämä käsite syntyy kahden teorian yhdistelmä- ja kokeellisista tiedoista: valenssisidoksen (TEV) ja valenssikuoren (VSPR) elektronisten parien kumoamisesta. Vaikka ensimmäinen määrittelee linkit ja niiden kulmat, toinen muodostaa geometrian ja siten molekyylirakenteen.

Mitkä geometriset muodot ovat molekyylejä, jotka pystyvät ottamaan vastaan? Kaksi aiempaa teoriaa tarjoavat vastaukset. VSEPR: n mukaan vapaiden elektronien atomit ja parit on järjestettävä avaruuteen siten, että niiden välissä oleva sähköstaattinen hylkintä minimoidaan..
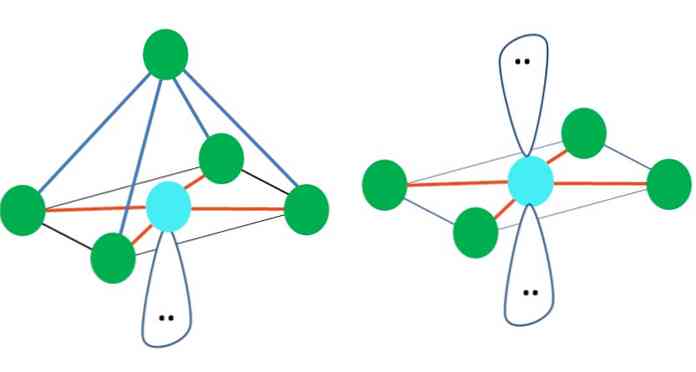
Joten geometriset muodot eivät ole mielivaltaisia, vaan etsivät kaikkein vakainta muotoilua. Esimerkiksi ylemmässä kuvassa vasemmalle voidaan nähdä kolmio ja oikealle oktaedri. Vihreät pisteet edustavat atomeja ja oranssi raitaa linkkejä.
Kolmiolla kolme vihreää pistettä on suunnattu 120 º: n erotukseksi. Tämä kulma, joka on yhtä suuri kuin sidoksen, sallii atomien torjua toisiaan mahdollisimman vähän. Siksi molekyyli, jossa on keski-atomi, joka on kiinnitetty kolmeen muuhun, ottaa käyttöön trigonaalisen tason geometriaa.
VSCR ennustaa kuitenkin, että vapaan elektronien pari keskiatomissa vääristää geometriaa. Trigonaalisen tason tapauksessa tämä pari työntää alas kolme vihreää pistettä, mikä johtaa trigonaalisen pyramidin geometriaan.
Sama voi tapahtua myös kuvan oktaedrilla. Siinä kaikki atomit erotetaan mahdollisimman vakaalla tavalla.
indeksi
- 1 Miten etukäteen tiedetään atomin X molekyyli geometria?
- 2 tyyppiä
- 2.1 Lineaarinen
- 2.2 Kulma
- 2.3 Tetrahedral
- 2.4 Trigonaalinen bipyramidi
- 2.5 Oktaedraali
- 2.6 Muut molekyylien geometriat
- 3 Esimerkkejä
- 3.1 Lineaarinen geometria
- 3.2 Kulma-geometria
- 3.3 Trigonaalinen suunnitelma
- 3.4 Tetrahedral
- 3.5 Trigonaalinen pyramidi
- 3.6 trigonaalinen bipyramidi
- 3.7 Värähtely
- 3.8 T: n muoto
- 3.9 Oktaedraali
- 4 Viitteet
Miten etukäteen tiedetään atomin X molekyyli geometria?
Tätä varten on myös harkittava vapaiden elektronien paria elektronisina ryhminä. Nämä yhdessä atomien kanssa määrittelevät sen, mitä kutsutaan nimellä elektroninen geometria, joka on erottamaton molekyyli- geometrian kumppani.
Elektronisesta geometriasta ja Lewisin rakenteen perusteella ilmaisten vapaiden elektronien parit pystymme määrittämään, mikä molekyylimuoto on. Kaikkien molekyylien geometrioiden summa antaa yleiskuvan globaalista rakenteesta.
tyyppi
Kuten pääkuvassa nähdään, molekyyli- geometria riippuu siitä, kuinka monta atomia ympäröi keskiatomia. Jos elektronien pari on kuitenkin läsnä ilman jakamista, se muuttaa geometriaa, koska sillä on paljon äänenvoimakkuutta. Siksi sillä on steerinen vaikutus.
Tämän mukaisesti geometria voi esittää joukon tunnusomaisia muotoja monille molekyyleille. Ja tässä syntyy erilaisia molekyyli- geometria- tai molekyylirakenteita.
Milloin geometria vastaa rakennetta? Molemmat merkitsevät samaa vain silloin, kun rakenteessa ei ole enemmän kuin yhtä tyyppistä geometriaa; muuten kaikki nykyiset tyypit on otettava huomioon ja rakenne on esitettävä kokonaisuudessaan (lineaarinen, haarautunut, pallomainen, tasainen jne.).
Geometriat ovat erityisen käyttökelpoisia selittämään kiinteän aineen rakennetta sen rakenneyksiköistä.
lineaarinen
Kaikki kovalenttiset sidokset ovat suunnattuja, joten yhteys A-B on lineaarinen. Mutta onko AB-molekyyli lineaarinen?2? Jos kyllä, geometria on yksinkertaisesti edustettuna: B-A-B. Kaksi B-atomia on erotettu 180 °: n kulmalla, ja TEV: n mukaan A: lla on oltava sp hybridi-orbitaaleja.
kulmikas
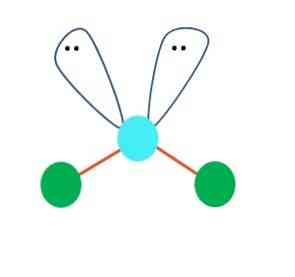
Ensimmäisessä tapauksessa voidaan olettaa, että AB-molekyyli on lineaarinen2; On kuitenkin välttämätöntä vetää Lewisin rakenne ennen johtopäätöksen tekemistä. Piirtämällä Lewisin rakennetta voidaan tunnistaa elektronien parien määrä jakamatta (:) A: n atomissa.
Kun näin on, elektroniparien päällä ne työntävät B-kahta atomia alaspäin muuttamalla niiden kulmia. Tämän seurauksena lineaarinen molekyyli B-A-B muuttuu V: ksi, bumerangiksi tai kulma-geometriaksi (ylempi kuva)
Vesimolekyyli, H-O-H, on ihanteellinen esimerkki tällaiselle geometrialle. Happiatomissa on kaksi elektronien paria ilman jakamista, jotka on suunnattu suunnilleen 109 ° kulmaan.
Miksi tämä kulma? Koska elektroninen geometria on tetraedrinen, jossa on neljä pisteitä: kaksi H-atomille ja kaksi elektronille. Yllä olevassa kuvassa huomaa, että vihreät pisteet ja kaksi "silmää" pitävät tetraedronin sinisen pisteen keskellä.
Jos O: lla ei olisi vapaita elektronipareja, vesi muodostaisi lineaarisen molekyylin, sen polariteetti vähenisi ja valtameret, meret, järvet jne. Eivät todennäköisesti olisi olemassa, koska ne ovat tunnettuja.
tetraedrielementtiverkossa
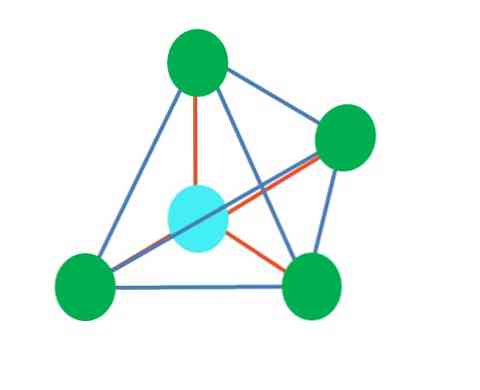
Ylempi kuva edustaa tetraedristä geometriaa. Vesimolekyylin elektroninen geometria on tetraedrinen, mutta eliminoimalla elektronittomat parit voidaan huomata, että se muunnetaan kulma-geometriaksi. Tämä havaitaan myös yksinkertaisesti poistamalla kaksi vihreää pistettä; loput kaksi piirtävät V: n sinisen pisteellä.
Entä jos kahden vapaan elektronin parin sijasta olisi vain yksi? Sitten olisi trigonaalitaso (pääkuva). Poistamalla sähköinen ryhmä ei kuitenkaan vältetä vapaiden elektronien parin tuottamaa steeristä vaikutusta. Siksi se vääristää trigonaalista tasoa kolmiomaisen pohjapyramidin kanssa:

Vaikka trigonaalinen ja tetraedrinen pyramidimolekyyli geometria ovat erilaisia, elektroninen geometria on sama: tetraedrinen. Niinpä trigonaalinen pyramidi ei ole elektroninen geometria?
Vastaus on ei, koska se on "lohen silmien" aiheuttama vääristymä ja sen steerinen vaikutus, eikä tämä geometria ota huomioon myöhempiä vääristymiä.
Tästä syystä on aina tärkeää määritellä ensin elektroninen geometria Lewis-rakenteiden avulla ennen molekyyli- geometrian määrittämistä. Ammoniakkimolekyyli, NH3, on esimerkki trigonaalisen pyramidin molekyyli- geometriasta, mutta on tetraedrinen elektroninen geometria.
Trigonaalinen bipyramidi
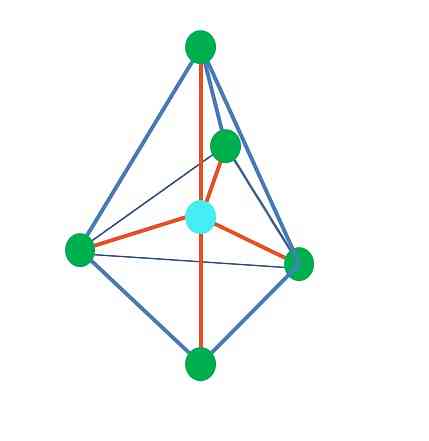
Tähän asti, lineaarista geometriaa lukuun ottamatta, tetraedrillisessa kulmassa ja trigonaalisessa pyramidissa on sen keskiatomeja spybridisoitumassa3, TEV: n mukaan. Tämä tarkoittaa, että jos linkkikulmat määritettiin kokeellisesti, niiden pitäisi olla noin 109º.
Trigonaalisesta dipiramidin geometriasta on viisi elektronista ryhmää keskiatomin ympärillä. Ylemmässä kuvassa näet viiden vihreän pisteen; kolme kolmion pohjassa ja kaksi aksiaalisessa asennossa, jotka ovat pyramidin ylä- ja alareunat.
Mitä hybridisaatiota sininen piste on? Se tarvitsee viisi hybridi-orbitaalia muodostamaan yksinkertaiset sidokset (oranssi). Tämä saavutetaan viiden sp orbitalin kautta3d (orbitaalisen s: n, kolmen p: n ja a: n seoksen tuote).
Kun tarkastellaan viittä elektronista ryhmää, geometria on se, joka on jo altistunut, mutta jossa on elektronien paria jakamatta, tämä taas kärsii vääristymistä, jotka tuottavat muita geometrioita. Seuraavaksi tulee myös kysymys: voiko nämä parit sijoittaa mihin tahansa paikkaan pyramidissa? Nämä ovat aksiaalinen tai ekvatoriaalinen.
Aksiaaliset ja ekvatoriaaliset asemat
Kolmiomaisen pohjan muodostavat vihreät kohdat ovat ekvatoriaalisissa asennoissa, kun taas kaksi ylä- ja alapäässä aksiaalisissa asennoissa. Missä mieluiten sijoitetaan elektronien pari ilman jakamista? Tässä asennossa, joka minimoi sähköstaattisen tukahdutuksen ja steerisen vaikutuksen.
Aksiaaliasennossa elektronipari "painaisi" kohtisuoraan (90º) kolmikulmaiseen alustaan, kun taas jos se olisi tasa-asennossa, kaksi jäljellä olevaa alustan elektronista ryhmää olisivat 120º: n päässä toisistaan ja paina molempia päät 90 °: ssa ( kolme, kuten pohjaan nähden.
Siksi keskiatomi pyrkii suuntaamaan elektronittomia pariasa ekvatoriaalisissa paikoissa tuottamaan vakaampia molekyyli- geometrioita.
Värähtelevä ja T-muoto
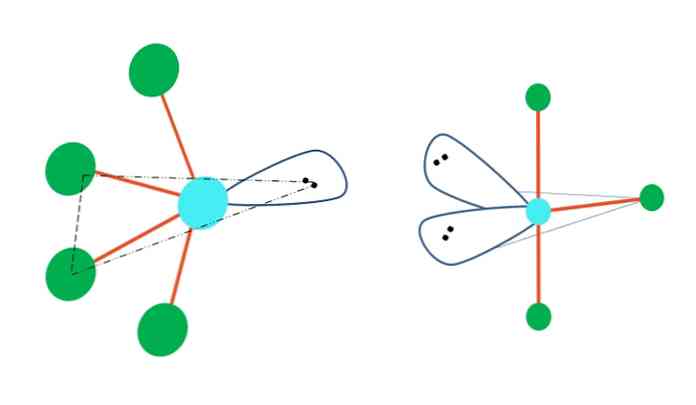
Jos trigonaalinen bipyramidigeometria korvaisi yhden tai useamman sen atomin elektronittomien parien kanssa, sillä olisi myös erilaiset molekyylipohjaiset geometriat.
Ylimmän kuvan vasemmalla puolella geometria muuttuu värähtelevään muotoon. Siinä vapaa elektronien pari työntää loput neljästä atomista samaan suuntaan, taittamalla niiden linkit vasemmalle. Huomaa, että tämä pari ja kaksi atomeista sijaitsevat alkuperäisen dipyramidin samassa kolmikulmaisessa tasossa.
Kuvasta oikealla puolella T-muotoinen geometria Tämä molekyyligeometria on seurausta kahden atomin korvaamisesta kahdelle elektroniparille, mikä johtaa siihen, että loput kolme atomia ovat linjassa samassa tasossa, joka piirtää täsmälleen yhden kirjaimen T.
Niinpä tyypin AB molekyylille5, se hyväksyy trigonaalisen bipyramidin geometrian. AB kuitenkin4, samalla elektronisella geometrialla, se ottaa käyttöön värähtelevän geometrian; ja AB3, T-muotoisella geometrialla A: lla on (yleensä) sp hybridisaatio3d.
Molekyyligeometrian määrittämiseksi on tarpeen vetää Lewisin rakenne ja sen vuoksi sen elektroninen geometria. Jos tämä on trigonaalinen bipyramidi, niin elektronittomat parit hylätään, mutta ei niiden steerisiä vaikutuksia muuhun atomiin. Siten on mahdollista erottaa täydellisesti kolme mahdollista molekyyli- geometriaa.
oktaedrisen
Oktaedraalinen molekyyligeometria esitetään pääkuvan oikealla puolella. Tämäntyyppinen geometria vastaa AB-yhdisteitä6. AB4 ne muodostavat neliön pohjan, kun taas kaksi muuta B: tä on sijoitettu aksiaalisiin paikkoihin. Täten muodostuu useita tasasivuisia kolmioita, jotka ovat oktaedrin kasvoja.
Tässäkin taas voi olla (kuten kaikissa elektronisissa geometrioissa) vapaita elektronipareja, ja tästä syystä muutkin molekyyli- geometriat johtuvat tästä. Esimerkiksi AB5 oktaedrisen elektronisen geometrian kanssa muodostuu neliöpohjainen pyramidi ja AB4 neliön tasosta:
Kun kyseessä on oktaedrinen elektroninen geometria, nämä kaksi molekyyli- geometriaa ovat kaikkein stabiileimpia sähköstaattisen vastuksen suhteen. Neliön tasomaisessa geometriassa nämä kaksi elektroniparia ovat 180 °: n päässä toisistaan.
Mikä on näiden geometrioiden (tai rakenteiden, jos se on ainoa) atomin A hybridisaatio? Jälleen TEV toteaa, että se on sp3d2, kuusi hybridi-orbitaalia, jotka mahdollistavat A: n suunnata elektronisia ryhmiä oktaedronin huippuihin.
Muut molekyylien geometriat
Modifioimalla toistaiseksi mainittujen pyramidien emäkset voidaan saada joitakin monimutkaisempia molekyylimuotoisia geometrioita. Esimerkiksi viisikulmainen bipyramidi perustuu pentagoniin ja sen muodostaviin yhdisteisiin on yleinen kaava AB7.
Muiden molekyylien geometristen tapojen mukaan B-atomien korvaaminen elektronittomien parien kohdalla vääristää geometriaa muuhun muotoon.
Myös AB-yhdisteet8 he voivat ottaa käyttöön geometrian, kuten neliön antiprismin. Jotkin geometriat voivat olla hyvin monimutkaisia, erityisesti AB-kaavojen osalta7 alkaen (enintään AB12).
esimerkit
Seuraavaksi mainitaan joukko yhdisteitä kullekin päämolekyyli- geometrialle. Harjoituksena voit piirtää Lewis-rakenteet kaikkiin esimerkkeihin ja varmentaa, jos saat sähköisen geometrian perusteella alla luetellut molekyylien geometriat..
Lineaarinen geometria
-Etyleeni, H2C = CH2
-Berylliumkloridi, BeCl2 (CI-Be-CI)
-Hiilidioksidi, CO2 (O = C = O)
-Typpi, N2 (N≡N)
-Elohopean dibromidi, HgBr2 (Br-Hg-Br)
-Anionitrijodidi, I3- (I-I-I)
-Vety syanidi, HCN (H-N≡C)
Sen kulmien on oltava 180º, ja niillä on siksi sp hybridisaatio.
Kulma-geometria
-Vesi
-Rikkidioksidi, SO2
-Typpidioksidi, NO2
-Otsoni, O3
-Anion amiduro, NH2-
Trigonaalinen taso
-Bromitrifluori, BF3
-Alumiinitrikloridi, AlCl3
-Nitraattianioni, NO3-
-Anionikarbonaatti, CO32-
tetraedrielementtiverkossa
-Metaanikaasu, CH4
-Hiilitetrakloridi, CCl4
-Kationiammonium, NH4+
-Anionisulfaatti, SO42-
Trigonaalinen pyramidi
-Ammoniakki, NH3
-Kationihydronium, H3O+
Trigonaalinen bipyramidi
-Fosforipentafluoridi, PF5
-Antimoni Pentakloridi, SbF5
värähtelevän
Rikkitetrafluoridi, SF4
T: n muoto
-Joditrikloridi, ICl3
-Kloriditrifluori, ClF3 (molemmat yhdisteet tunnetaan interhalogeeneina)
oktaedrisen
-Rikkiheksafluoridi, SF6
-Seleeniheksafluoridi, SeF6
-Heksafluorifosfaatti, PF6-
Molekyyligeometria on huipentuma, mikä selittää aineen kemiallisten tai fysikaalisten ominaisuuksien havainnot. Se on kuitenkin suunnattu elektronisen geometrian mukaisesti siten, että jälkimmäinen on aina määritettävä ennen ensimmäistä.
viittaukset
- Whitten, Davis, Peck & Stanley. Kemia. (8. painos). CENGAGE Learning, s. 194-198.
- Shiver & Atkins. (2008). Epäorgaaninen kemia (Neljäs painos., S. 23, 24, 80, 169). Mc Graw Hill.
- Mark E. Tuckerman. (2011). Molekyyligeometria ja VSEPR-teoria. Haettu osoitteesta: nyu.edu
- Virtual Chembook, Charles E. Ophardt. (2003). Johdatus molekyyligeometriaan. Haettu osoitteesta: chemistry.elmhurst.edu
- Kemia LibreTexts. (8. syyskuuta 2016). Molekyylien geometria. Haettu osoitteesta: chem.libretexts.org


