Natriumdikromaattiominaisuudet, tuotanto, vaarat ja käyttö
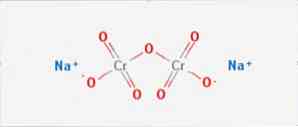
natriumdikromaatti on epäorgaaninen yhdiste, jolla on kaava Na2Cr2O7. Se on yksi monista kuusiarvoisista kromiyhdisteistä (Cr VI). Sen rakenne on esitetty kuviossa 1, vaikka yleensä suolaa käsitellään dihydratoidussa muodossaan, jonka kaava olisi Na2Cr2O7 · H2O.
Siinä on kaksi ionisidosta natriummolekyylien ja negatiivisesti varautuneiden oksygeenien välillä. Kromimalmi uutetaan natriumdikromaatista. Miljoonia kilogrammaa natriumdikromaattia tuotetaan vuosittain.
Kiina on suurin natriumdikromaatin tuottaja, mutta kiinalaisten kemikaalitehtaiden tuotanto on suhteellisen alhainen, alle 50 000 tonnia vuodessa, verrattuna Kazakstanin tehtaalle, joka tuottaa yli 100 000 tonnia vuodessa.
Venäjällä, Yhdysvalloissa ja Yhdistyneessä kuningaskunnassa sijaitsevilla kasveilla on välituotanto 50 000–100 000 tonnia vuodessa (Kogel, 2006).
Reaktiivisuuden ja ulkonäön suhteen natriumdikromaatilla on samanlaisia ominaisuuksia kuin kaliumdikromaatti, mutta natriumsuola on liukoisempi veteen ja sen painoekvivalentti on vähemmän kuin kaliumsuola.
Natriumdikromaatti tuottaa myrkyllisiä kromihöyryjä kuumennettaessa. Se on voimakas hapettava aine ja se on erittäin syövyttävä.
Tämä yhdiste löytyy juomaveden lähteistä, jotka ovat saastuneet erilaisilla teollisilla prosesseilla, kuten galvanointitekniikoilla tai galvanointitekniikoilla, nahan parkituksella ja tekstiilien valmistuksella.
indeksi
- 1 Fysikaaliset ja kemialliset ominaisuudet
- 2 Tuotantomenetelmät
- 3 Reaktiivisuus ja vaarat
- 4 Käyttö ja sovellukset
- 5 Biokemia
- 6 Viitteet
Fysikaaliset ja kemialliset ominaisuudet
Natriumdikromaatti koostuu kiteistä, joissa on punertavan oranssin monokliininen rakenne vedettömässä ja hajuttomassa muodossa. Sen molekyylipaino on 261,97 g / mol vedettömässä muodossa ja 298,00 g / mol sen dihydratoidussa muodossa.
Sen sulamispiste on 356,7 astetta, kiehumispiste 400 ° C, jossa se hajoaa. Sen tiheys on 2,52 g / ml.

Kuvio 2 esittää natriumdikromaatin ulkonäköä. Sen liukoisuus veteen on 187 g / 100 grammaa 25 celsiusasteessa ja sen liukoisuus etanoliin on 513,2 grammaa litrassa 19,4 celsiusasteessa (kansallinen bioteknologian informaatiokeskus, s.f.).
Sitä pidetään stabiilina yhdisteinä, jos sitä säilytetään suositelluissa olosuhteissa eikä se ole syttyvää. Koska se on voimakas hapetin, se on syövyttävää, ja liuoksessa on happoa, joka kykenee alentamaan pH: n arvoon 4 liuoksessa, jossa on 1 paino-%..
Tuotantomenetelmät
Natriumkromaatti voidaan muuttaa dikromaatiksi jatkuvalla prosessilla, joka käsittelee rikkihappoa, hiilidioksidia tai näiden kahden yhdistelmää..
Natriumdikromaattiliuoksen haihtuminen aiheuttaa natriumsulfaatin ja / tai natriumbikarbonaatin saostumisen, ja nämä yhdisteet poistetaan ennen natriumdikromaatin lopullista kiteytymistä..
Natriumdikromaatti voidaan tehdä kolmivaiheisessa prosessissa:
- Kromiittihapetusolosuhteiden alkalinen paahtaminen
- Huuhtoutuminen. Liukoisen aineen uuttaminen seoksesta nestemäisen liuottimen vaikutuksesta
- Natriummonokromaatin muuntaminen natriumdikromaatiksi hapon avulla.
Vedetön natriumdikromaatti voidaan valmistaa sulattamalla natriumdihydraattidihydraattia, kiteyttämällä vesipitoisia dikromaattiliuoksia yli 86 ° C: ssa tai kuivattamalla natriumdikromaattiliuoksia suihkukuivaimissa.
Natriumdikromaattiliuoksia, joiden pitoisuus on 69 ja 70 painoprosenttia, käytetään kätevänä ja kustannustehokkaana menetelmänä määrien lähettämiseksi, jolloin vältetään tarve manuaaliseen käsittelyyn tai kiteiden liukenemiseen.
Reaktiivisuus ja vaarat
Se on voimakas hapetin. Yhteensopimaton vahvojen happojen kanssa. Kosketus palavien aineiden kanssa voi aiheuttaa tulipalon. Kromioksidin myrkylliset höyryt voidaan muodostaa lämmön tai tuleen läsnä ollessa.
Tunnetun dikromaatin ja rikkihapon "kromihapposeos", jossa on orgaanisia tähteitä, saa aikaan voimakkaan eksotermisen reaktion. Tämä seos yhdessä asetonitähteiden kanssa johtaa myös väkivaltaiseen reaktioon.
Dikromaatin ja rikkihapon yhdistelmä alkoholien, etanolin ja 2-propanolin kanssa johtaa voimakkaaseen eksotermiseen reaktioon. Monien tapausten vuoksi, joissa on sekoitettu dikromaatti-rikkihappoa hapettavien orgaanisten aineiden kanssa, on todennäköisesti parasta välttää tällaiset vuorovaikutukset.
Dikromaatin ja hydratsiinin yhdistelmä on räjähdysherkkä, dikromaattireaktion odotetaan olevan voimakasta amiinien kanssa yleensä. Dehydratoidun dikromaattisuolan lisääminen etikkahappoanhydridiin johtaa lopulta räjähtävään eksotermiseen reaktioon.
Boori, pii ja dikromaatit muodostavat pyroteknisiä seoksia. Etikkahapon, 2-metyyli-2-pentenalin ja dikromaatin seos johtaa rehottavaan reaktioon (Chemical Datasheet Sodium Dichromate., 2016).
Pölyn tai sumun hengittäminen aiheuttaa hengitysteiden ärsytystä, joka toisinaan muistuttaa astmaa. Septanttiperforaatio voi ilmetä. Sitä pidetään myrkynä.
Nieleminen aiheuttaa oksentelua, ripulia ja erittäin epätavallisen mahalaukun ja munuaisten komplikaatioita. Roiskeet silmiin tai ihoon aiheuttavat paikallista ärsytystä. Toistuva altistuminen iholle aiheuttaa dermatiittia.
Natriumdikromaatti on ihmisissä syöpää aiheuttava aine. On näyttöä siitä, että kuusiarvoiset kromiyhdisteet tai Cr (VI) voivat aiheuttaa keuhkosyövän ihmisillä. On osoitettu, että natriumdikromaatti aiheuttaa keuhkosyöpää eläimissä.
Vaikka natriumdikromaattia ei ole todettu teratogeeniseksi yhdisteeksi tai lisääntymisriskiksi, on tiedossa, että kuusiarvoiset kromiyhdisteet tai Cr (VI) ovat teratogeenisiä ja aiheuttavat lisääntymisvaurioita, kuten hedelmällisyyden vähentäminen ja kuukautiskierron häiritseminen.
Natriumdikromaatti voi aiheuttaa maksan ja munuaisvaurion, joten sitä on hoidettava erittäin huolellisesti (New Jersey Department of Health, 2009).
Nielemisen yhteydessä uhrin tulee juoda vettä tai maitoa; älä koskaan aiheuta oksentelua. Jos iho tai silmät joutuvat kosketuksiin, se on käsiteltävä happaman palovammana; Huuhtele silmät vedellä vähintään 15 minuutin ajan.
Ulkoiset vauriot voidaan hieroa 2% natriumtiosulfaatin liuoksella. Kaikissa tapauksissa on neuvoteltava lääkärin kanssa.
Käyttö ja sovellukset
Sen lisäksi, että natriumdikromaatti on tärkeä muiden kromikemikaalien valmistuksessa, sillä on myös monia suoria käyttötarkoituksia ainesosana seuraavien tuotteiden valmistuksessa:
- Metallinen viimeistely: auttaa korroosionkestävyyttä ja puhdistaa metallipinnat, myös suosii maalin tarttumista.
- Orgaaniset tuotteet: käytetään hapettavina aineina valmistettaessa tuotteita, kuten K-vitamiinia ja vahaa.
- Pigmentit: käytetään epäorgaanisten kromaattipigmenttien valmistuksessa, jossa se tuottaa värivalikoiman, joka on vakaa valolle. Alhaisissa kerroksissa ja alukkeissa korroosion estäjinä käytetään myös eräitä kromaattilajeja.
- Keraamiset: käytetään värillisten lasien ja keraamisten lasien valmistukseen.
- Tekstiili: käytetään happamien väriaineiden manttina, joka parantaa sen nopeasti värjääviä ominaisuuksia.
- Kromisulfaatin tuotanto.
(Natriumdikromaatti, käytännöllisesti katsoen kaikkien muiden kromiyhdisteiden rakennuspalikka., 2010-2012)
Natriumdikromaatti Dihydraatti, sen käyttö on ihanteellinen eri olosuhteissa, mukaan lukien korkean lämpötilan sovellukset, kuten keraamiset lasit ja värillinen lasi.
Kromioksidi, joka on kovempi kuin muut metallioksidit, kuten titaani tai rauta, on ihanteellinen ympäristöihin, joissa lämpötila ja prosessin olosuhteet ovat aggressiivisia.
Tätä ainetta käytetään pääasiassa muiden kromiyhdisteiden valmistukseen, mutta sitä käytetään myös bentoniittisumuissa, joita käytetään öljyn valmistuksessa, puunsuoja-aineissa, orgaanisten kemikaalien valmistuksessa ja korroosionestoaineena..
Kun alumiini- ja kaliumdikromaattia sekoitetaan alumiini-lämpöprosessia käyttäen, kromioksidi tuottaa erittäin puhdasta metallista kromia. Tämä on olennainen ainesosa ilmailu- ja avaruusteollisuudessa käytettävien korkean suorituskyvyn superkerrosten valmistuksessa.
Orgaanisessa synteesissä natriumdikromaattia käytetään hapetusaineena pelkistysoksidireaktioissa rikkihapon läsnä ollessa.
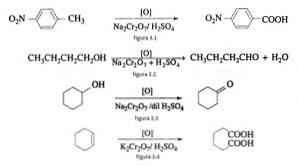
Esimerkiksi p-nitrotolueenin hapettaminen p-nitrobentsoehapon muodostamiseksi n-butanolin hapetuksessa n-butaldehydin muodostamiseksi sykloheksanolin muodostamisessa sykloheksanolista ja adipiinihapon muodostumisesta, kuten kuvioissa 3.1 on esitetty. , 3,2, 3,3 ja 3,4 (VK Ahluwalia, 2004).
biokemia
Natriumdikromaatin (CrVI) ja kromiasetaattihydroksidin (CrIII) intratrakeaalinen injektointi urosrotissa lisäsi kromipitoisuuksia kokoveressä, plasmassa ja virtsassa jopa 72 tunnin ajan altistuksen jälkeen; Suurimmat pitoisuudet saavutettiin 6 tuntia altistuksen jälkeen.
Kokoveren kromin ja plasman kromipitoisuuksien suhde oli merkittävästi erilainen Cr (VI) ja Cr (III) -hoidoissa. Tämän vuoksi kromin altistumisen arvioinnissa on käytettävä veressä ja kromissa olevia kromia koskevia analyysejä.
Kromi havaittiin myös perifeerisissä lymfosyyteissä. Cr (VI), mutta ei Cr (III), kertyi merkittävästi lymfosyyteissä hoidon jälkeen. Näillä soluilla on mahdollisuus käyttää biomarkkereina kromiyhdisteiden altistumisen arvioinnissa (Hooth, 2008).
viittaukset
- Kemiallinen Datalehdet Natriumdikromaatti. (2016). Haettu koti kemikaaleista: cameochemicals.noaa.
- Hooth, M. J. (2008). Tekninen raportti natriumdikromaatin dihydratoidun toksikologian ja karsinogeenisuuden tutkimuksista. Kansallinen terveyslaitos USA.
- Kogel, J. E. (2006). Teollisuuden kivennäisaineet ja kalliot: hyödykkeet, markkinat ja seitsemäs painos. littleton colorado: kaivos-, metallurgia- ja etsintäyhteisö.
- Kansallinen bioteknologian tiedotuskeskus. (N.D.). PubChem-yhdistelmätietokanta; CID = 25408. Haettu osoitteesta pubchem.com: pubchem.ncbi.nlm.nih.gov.
- New Jerseyn terveysministeriö. (2009, marraskuu). Hazarddous aine tosiasiallinen natriumdikromaatti. Haettu osoitteesta nj.gov: nj.gov.
- Natriumdikromaatti. Rakennuskappale lähes kaikille muille kromiyhdisteille. (2010-2012). Haettu elementistä chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Kattava käytännön orgaaninen kemia: valmistelut ja kvantitatiiviset analyysit. Delhi: yliopiston lehdistö (Intia).


