Kemiallisten yhtälöiden menetelmien ja esimerkkien tasapainottaminen
kemiallisten yhtälöiden tasapainottaminen tarkoittaa, että kaikilla mainitussa yhtälössä olevilla elementeillä on sama määrä atomeja kummallakin puolella. Tämän saavuttamiseksi on välttämätöntä käyttää tasapainotusmenetelmiä, jotta kullekin reaktiossa olevalle lajille sopivat stoikiometriset kertoimet osoitetaan..
Kemiallinen yhtälö on symboleilla esityksen esittäminen siitä, mitä tapahtuu kahden tai useamman aineen välisen kemiallisen reaktion aikana. Reagoivat aineet vuorovaikutuksessa keskenään ja reaktio-olosuhteista riippuen saadaan yksi tai useampia erilaisia yhdisteitä tuotteena..
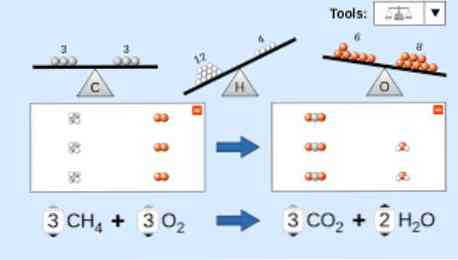
Kun kuvataan kemiallista yhtälöä, on otettava huomioon seuraavat seikat: Ensinnäkin reagenssin aineet kirjoitetaan yhtälön vasemmalle puolelle, jota seuraa yksisuuntainen nuoli tai kaksi vastakkaista vaakasuoraa nuolta suoritettavan reaktion tyypistä riippuen. viitta.
indeksi
- 1 Menetelmät kemiallisten yhtälöiden tasapainottamiseksi
- 1.1 Kemiallisten yhtälöiden tasapaino kokeilla ja virheillä (kutsutaan myös tarkastuksella tai kokeilulla)
- 1.2 Kemiallisten yhtälöiden algebrallinen tasapainotus
- 1.3 Redox-yhtälöiden rullaaminen (ioni-elektroni-menetelmä)
- 2 Esimerkkejä kemiallisten yhtälöiden tasapainottamisesta
- 2.1 Ensimmäinen esimerkki
- 2.2 Toinen esimerkki
- 2.3 Kolmas esimerkki
- 3 Viitteet
Kemiallisten yhtälöiden tasapainotusmenetelmät
Perusteena siitä, että reagenssit ja tuotteet ovat tunnettuja ja että niiden kaavat on ilmaistu oikein niitä vastaavalla puolella, jatkamme yhtälöiden tasapainottamista seuraavien menetelmien mukaisesti.
Kemiallisten yhtälöiden tasapainottaminen kokeilla ja virheillä (kutsutaan myös tarkastuksella tai kokeilulla)
Se perustuu reaktion stökiometriseen analyysiin ja yrittää kokeilla eri kertoimia yhtälön tasapainottamiseksi, kunhan valitaan pienimmät mahdolliset kokonaisluvut, joilla kummallakin puolella saadaan sama määrä atomeja molemmilta puolilta reaktion.
Reagenssin tai tuotteen kerroin on numero, joka edeltää sen kaavaa, ja se on ainoa numero, jota voidaan muuttaa yhtälön tasapainottamisessa, koska kaavojen alikoodien muuttaminen muuttaisi yhdisteen identiteettiä kysymyksessä.
Laske ja vertaa
Kun olet tunnistanut jokaisen reaktioelementin ja sijoittanut sen oikeaan puoleen, laskemme ja verrataan yhtälössä olevien elementtien atomien lukumäärää ja määritetään ne, jotka on tasapainotettava.
Sitten jatkamme kunkin elementin tasapainottamista (yksi kerrallaan) asettamalla kokonaiset kertoimet jokaista kaavaa kohti, joka sisältää epätasapainoisia elementtejä. Yleensä metalliset elementit tasapainotetaan ensin, sitten ei-metalliset elementit ja lopuksi happi- ja vetyatomit.
Tällä tavoin kukin kerroin kertoo kaikki edellisen kaavan atomit; joten kun elementtiä tasapainotetaan, muut voivat epätasapainoa, mutta tämä korjataan, kun reaktio on tasapainossa.
Lopuksi se vahvistetaan viimeisellä laskulla, että koko yhtälö on oikein tasapainotettu eli että se noudattaa aineen säilyttämislakia.
Kemiallisten yhtälöiden algebrallinen tasapainotus
Tämän menetelmän käyttämiseksi on luotu menettely, jolla käsitellään sellaisten järjestelmien kemiallisten yhtälöiden kertoimia, jotka on ratkaistava järjestelmän tuntemattomiksi..
Ensinnäkin reaktion tietty elementti katsotaan referenssiksi ja kertoimet sijoitetaan kirjaimiksi (a, b, c, d ...), jotka edustavat tuntemattomia, kunkin molekyylin tämän elementin olemassa olevien atomien mukaan (jos laji ei sisällä tätä elementtiä "0").
Tämän ensimmäisen yhtälön saamisen jälkeen määritetään reaktiossa olevien muiden elementtien yhtälöt; siellä on yhtä monta yhtälöä, koska mainitussa reaktiossa on elementtejä.
Lopuksi tuntemattomat määritetään yhdellä pelkistys-, tasaus- tai substituutiomenetelmistä, ja kertoimet saadaan, jotka johtavat oikein tasapainotettuun yhtälöön.
Redox-yhtälöiden tasapainotus (ioni-elektroni-menetelmä)
Ensin yleinen (epätasapainoinen) reaktio sijoitetaan sen ionimuodossa. Sitten tämä yhtälö on jaettu kahteen puolireaktioon, hapettumiseen ja pelkistykseen, joista kukin tasapainottaa atomien lukumäärän, tyypin ja näiden maksujen mukaan..
Esimerkiksi reaktioissa, jotka esiintyvät happoväliaineessa, lisätään H-molekyylejä.2Tai tasapainottaa happiatomeja ja lisätä H+ tasapainottaa vetyatomeja.
Sitä vastoin alkalisessa väliaineessa lisätään sama määrä OH-ioneja- jokaisen H-ionin yhtälön kahdella puolella+, ja missä H-ionit nousevat+ ja OH- ne tulevat yhteen muodostamaan H-molekyylejä2O.
Lisää elektroneja
Sitten sinun on lisättävä niin monta elektronia kuin on tarpeen maksujen tasapainottamiseksi sen jälkeen, kun asia on tasapainotettu jokaisessa puoli-reaktiossa.
Kunkin puolireaktion kiertämisen jälkeen nämä lisätään ja huipentuvat tasapainottamalla lopullinen yhtälö kokeilla ja virheillä. Jos kahden puolireaktion elektronien lukumäärä eroaa, yksi tai molemmat on kerrottava kertoimella, joka on sama kuin tämä luku.
Lopuksi on vahvistettava, että yhtälö sisältää saman määrän atomeja ja samantyyppisiä atomeja, ja lisäksi niillä on samat maksut globaalin yhtälön molemmilla puolilla.
Esimerkkejä kemiallisten yhtälöiden tasapainottamisesta
Ensimmäinen esimerkki
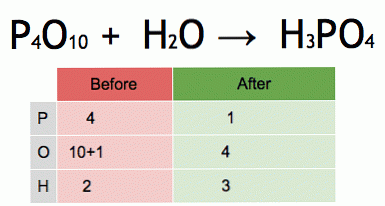
Tämä on tasapainoisen kemiallisen yhtälön animaatio. Fosforipentoksidi ja vesi muutetaan fosforihapoksi.
P4O10 + 6 H20 → 4 H3PO4 (-177 kJ).
Toinen esimerkki
Sinulla on etaanin palamisreaktio (epätasapainoinen).
C2H6 + O2 → CO2 + H2O
Käyttämällä kokeilu- ja virhemenetelmää sen tasapainottamiseksi havaitaan, että yksikään elementeistä ei ole samaa määrää atomia yhtälön molemmilla puolilla. Siten se alkaa hiilitasapainosta, lisäämällä siihen kaksi stoikiometristä kerrointa, joka liitetään siihen tuotteiden puolella..
C2H6 + O2 → 2CO2 + H2O
Hiili on tasapainotettu molemmilla puolilla, joten jatkamme vety tasapainottamista lisäämällä kolme vesimolekyyliin.
C2H6 + O2 → 2CO2 + 3H2O
Lopuksi, koska yhtälön oikealla puolella on seitsemän happiatomia ja se on viimeinen elementti, joka on vielä tasapainotettava, murto-osa 7/2 sijoitetaan happimolekyylin eteen (vaikka koko kertoimet ovat yleensä edullisia).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
Tarkista sitten, että yhtälön kummallakin puolella on sama määrä hiiliatomeja (2), vetyä (6) ja happea (7).
Kolmas esimerkki
Raudan hapettuminen dikromaattioneilla tapahtuu happamassa väliaineessa (epätasapainossa ja sen ionimuodossa).
usko2+ + op2O72- → Usko3+ + op3+
Ionelektronimenetelmää käyttämällä tasapainotusta varten se jaetaan kahteen puolireaktioon.
Hapetus: Usko2+ → Usko3+
Vähennys: Cr2O72- → Kr3+
Koska rauta-atomit ovat jo tasapainossa (1: 1), lisätään elektroni tuotteiden puolelle varauksen tasapainottamiseksi.
usko2+ → Usko3+ + ja-
Nyt Cr: n atomit ovat tasapainossa, lisäämällä kaksi yhtälön oikealle puolelle. Sitten kun reaktio tapahtuu happamassa väliaineessa, lisätään seitsemän H-molekyyliä.2Tai tuotteiden puolella tasapainottaa happiatomeja.
op2O72- → 2Cr3+ + 7H2O
H-atomien tasapainottamiseksi lisätään neljätoista H-ionia+ reagoivien aineiden puolella ja materiaalin tasaamisen jälkeen varaukset tasapainotetaan lisäämällä kuusi elektronia samalle puolelle.
op2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
Lopuksi lisätään molemmat puolireaktiot, mutta koska hapetusreaktiossa on vain yksi elektroni, kaikki tämä on kerrottava kuudella.
6Fe2+ + op2O72- +14H+ + 6e- → Usko3+ + 2ch3+ + 7H2O + 6e-
Lopuksi, elektronit on poistettava globaalin ionisen yhtälön molemmilta puolilta ja varmistettava, että niiden varaus ja aine on tasapainossa.
viittaukset
- Chang, R. (2007). Kemia. (9. painos). McGraw-Hill.
- Hein, M. ja Arena, S. (2010). Opiskelijakemian perusteet, varajäsen. Haettu osoitteesta books.google.co.ve
- Tuli, G. D. ja Soni, P. L. (2016). Kemia tai kemialliset yhtälöt. Haettu osoitteesta books.google.co.ve
- Speedy Publishing (2015). Kemiayhtälöt ja vastaukset (Speedy Study Guides). Haettu osoitteesta books.google.co.ve


