Tubulina Alfa ja beeta, toiminnot
tubuliinia on kaksoispolypeptidien muodostama globulaarinen dimeerinen proteiini: alfa-tubuliini ja beeta. Ne on järjestetty putken muodossa mikrotubuloiden muodostamiseksi, jotka yhdessä aktiinimikrofilamenttien ja välikalvojen kanssa muodostavat sytoskeletin.
Mikrotubuleja esiintyy erilaisissa olennaisissa biologisissa rakenteissa, kuten siittiöiden lippulaivassa, silioitujen organismien laajennuksissa, henkitorven silmukoissa ja munanjohtimissa..
Lisäksi tubulinaa muodostavat rakenteet toimivat kuljetusreitteinä -analogeina solun sisällä olevien materiaalien ja organellien raiteille. Aineiden ja rakenteiden siirtyminen on mahdollista mikrotubuluksiin liittyvien moottoriproteiinien, joita kutsutaan kinesiiniksi ja dyneiiniksi, ansiosta..
indeksi
- 1 Yleiset ominaisuudet
- 2 Tubuliini alfa ja beeta
- 3 Toiminnot
- 3.1 Sytoskeleton
- 3.2 Mitoosi
- 3.3 Centrosome
- 4 Evolutionaarinen näkökulma
- 5 Viitteet
Yleiset ominaisuudet
Tubuliinin alayksiköt ovat 55 000 daltonin heterodimeerejä ja ovat mikrotubulusten rakennuspalikoita. Tubuliinia esiintyy kaikissa eukaryoottisissa organismeissa, ja se on ollut erittäin konservoitunut evoluutiossa.
Dimeeri koostuu kahdesta polypeptidistä, joita kutsutaan tubuliini-alfa- ja beeta-ai- neiksi. Nämä polymeroidaan muodostamaan mikrotubuluksia, jotka koostuvat kolmestatoista protofilamentista, jotka on järjestetty yhdensuuntaisesti onton putken muodossa..
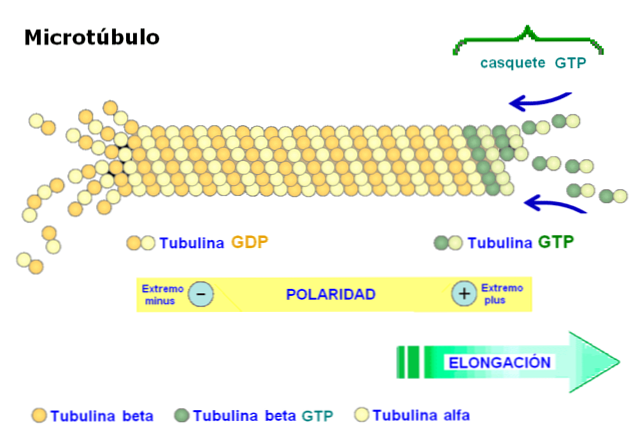
Yksi mikrotubulusten merkityksellisimmistä ominaisuuksista on rakenteen napaisuus. Toisin sanoen mikrotubulin kaksi päätä eivät ole samat: toista päätä kutsutaan nopeasti kasvavaksi päähän tai "enemmän", ja toinen pää on hidas kasvava tai "vähemmän"..
Polariteetti on tärkeä, koska se määrittää liikkeen suunnan mikrotubuliin. Tubuliinidimeeri kykenee polymeroimaan ja depolarisoimaan nopeassa kokoonpanokierrossa. Tämä ilmiö esiintyy myös aktiinifilamenteissa.
Alayksikköön kuuluu kolmas tyyppi: se on gamma-tubuliini. Tämä ei ole osa mikrotubuluksia ja se sijaitsee centrosomeissa; se osallistuu kuitenkin mikrotubuloiden nukleaatioon ja muodostumiseen.
Tubuliini-alfa ja beeta
Alfa- ja beeta-alayksiköt liittyvät voimakkaasti kompleksisen heterodimeerin muodostamiseen. Itse asiassa kompleksin vuorovaikutus on niin voimakasta, että se ei hajoa normaaleissa olosuhteissa.
Nämä proteiinit muodostuvat 550 aminohaposta, enimmäkseen happoja. Vaikka alfa- ja beeta-tubuliinit ovat melko samankaltaisia, ne on koodattu eri geeneillä.
Alfa-tubuliinissa voidaan löytää aminohappotähteitä asetyyliryhmällä, jolloin solun lipussa esiintyy erilaisia ominaisuuksia.
Kukin tubuliinin alayksikkö liittyy kahteen molekyyliin: alfa-tubuliinissa GTP sitoutuu peruuttamattomasti ja yhdisteen hydrolyysiä ei tapahdu, kun taas toinen sitoutumiskohta tubuliinibetassa sitoo palautuvasti GTP: tä ja hydrolysoi sen.
GTP: n hydrolyysi johtaa ilmiöön, jota kutsutaan "dynaamiseksi epävakaudeksi", jossa mikrotubulit käyvät läpi kasvu- ja hajoamisjaksoja riippuen tubuliiniriippuvuudesta ja GTP-hydrolyysin nopeudesta.
Tämä ilmiö muuttuu mikrotubuloiden suureksi vaihtuvuudeksi, jossa rakenteen puoliintumisaika on vain muutama minuutti.
tehtävät
sytoskeletonia
Tubuliinipolymeroinnin alfa- ja beeta-alayksiköt aiheuttavat mikrotubuluksia, jotka ovat osa sytoskelettia.
Mikrotubulusten lisäksi sytoskeleton koostuu kahdesta muusta rakenteellisesta elementistä: noin 7 nm: n aktiinimikrofilamenteista ja halkaisijaltaan 10-15 nm: n välituotekalvoista..
Sytoskeleton on solun kehys, se tukee ja ylläpitää solun muotoa. Kalvo ja subcellulaariset osastot eivät kuitenkaan ole staattisia ja liikkuvat jatkuvasti pystyäkseen toteuttamaan endosytoosin, fagosytoosin ja materiaalien erittymisen ilmiöitä.
Sytoskeletin rakenne sallii solun sopeutua täyttämään kaikki mainitut toiminnot.
Se on ihanteellinen väliaine solujen organelleihin, plasmamembraaniin ja muihin solukomponentteihin tavallisten toimintojensa suorittamiseksi solujen jakautumisen lisäksi.
Ne myötävaikuttavat myös solujen liikkeiden ilmiöihin, kuten amoebas-liikkumiseen, ja erikoisrakenteisiin siirtymiseen, kuten silmukoihin ja flagellaan. Lopuksi se on vastuussa lihasten liikkumisesta.
mitoosin
Dynaamisen epävakauden ansiosta mikrotubuliat voidaan järjestää täysin uudelleen solunjakautumisprosessin aikana. Mikrotubulusovitelma rajapinnan aikana pystyy purkamaan ja tubuliinin alayksiköt ovat vapaita.
Tubuliini voi koota uudelleen ja saada aikaan mitoottisen karan, joka osallistuu kromosomien erottamiseen.
On olemassa tiettyjä lääkkeitä, kuten kolkisiinia, taksolia ja vinblastiinia, jotka keskeyttävät solujen jakautumisprosessit. Toimii suoraan tubuliinimolekyyleihin, jotka vaikuttavat mikrotubulusten kokoonpano- ja dissosiaatio-ilmiöön.
sentrosomimäärän
Eläinsoluissa mikrotubulit ulottuvat keskusosomiin, joka on lähellä ydintä muodostettu rakenne, jonka muodostavat pari senttimetriä (kumpikin suuntautuvat kohtisuoraan) ja jota ympäröi amorfinen aine, jota kutsutaan pericentriolarimatriisiksi..
Centriolit ovat sylinterimäisiä kappaleita, jotka on muodostettu yhdeksästä mikrotubulusten kolmikerroksesta, organisaatiossa, joka on samanlainen kuin solukalvo ja lippu.
Solunjakautumisprosessissa mikrotubulit ulottuvat centrosomeista, jotka muodostavat mitoottisen karan, joka vastaa kromosomien oikeasta jakautumisesta uusiin tyttärisoluihin..
Näyttää siltä, että sentrifolit eivät ole välttämättömiä mikrotubulusten kokoamisessa solujen sisällä, koska ne eivät ole läsnä kasvisoluissa tai joissakin eukaryoottisoluissa, kuten tiettyjen jyrsijöiden munasoluissa.
Pericentriolarimatriisissa aloitetaan mikrotubulusten kokoaminen, jossa nukleaatio tapahtuu gammasubuliinin avulla..
Evolutionaarinen näkökulma
Kolme tubuliinityyppiä (alfa, beeta ja gamma) koodaa eri geenit ja ne ovat homologisia prokaryoottien sisältämälle geenille, joka koodaa 40 000 daltonin proteiinia, nimeltään FtsZ. Bakteeriproteiini on toiminnallisesti ja rakenteellisesti samanlainen kuin tubuliini.
On todennäköistä, että proteiinilla oli bakteereissa esivanhempi funktio ja sitä modifioitiin evoluutioprosessien aikana, jolloin proteiinissa tehtiin funktioita, joita se esiintyy eukaryooteissa..
viittaukset
- Cardinali, D. P. (2007). Sovellettu neurotiede: sen perustukset. Ed. Panamericana Medical.
- Cooper, G.M. (2000). Solu: Molekyylinen lähestymistapa. 2. painos. Sunderland (MA): Sinauer Associates.
- Curtis, H., & Schnek, A. (2006). Kutsu biologiaan. Ed. Panamericana Medical.
- Frixione, E., & Meza, I. (2017). Elävät koneet: Miten solut liikkuvat?. Talouskulttuurirahasto.
- Lodish H, Berk A, Zipursky SL, et ai. (2000). Molekyylisolubiologia. 4. painos. New York: W. H. Freeman.


