Histonien ominaisuudet, rakenne, tyypit ja toiminnot
histonit ovat emäksisiä proteiineja, jotka ovat vuorovaikutuksessa DNA: n kanssa nukleosomien muodostamiseksi, jotka muodostavat kromatiinin säikeet, jotka muodostavat kromosomit eukaryoottisissa organismeissa.
Nukleosomit, DNA: n ja proteiinien muodostamat kompleksit löydettiin vuonna 1974 ja histonit kokoavat tämän kromatiinin organisaation perusvaiheen. Histoniproteiinien olemassaolo on kuitenkin tiedossa jo 1960-luvulta lähtien.
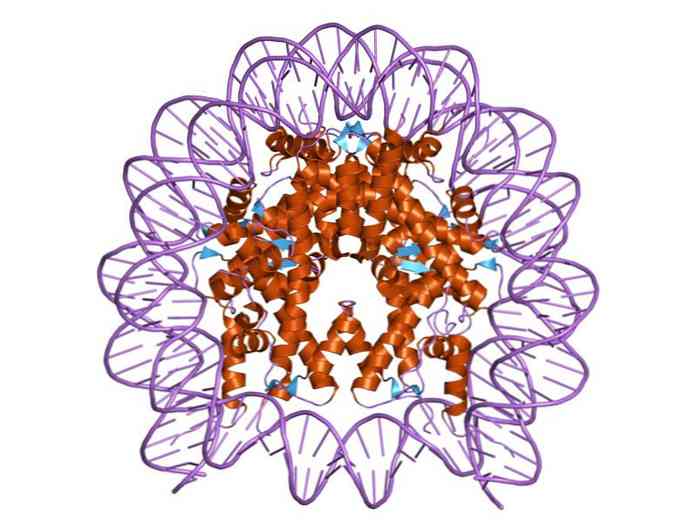
Histonit on järjestetty siten, että DNA-kaksoisnauha kääritään proteiinikeskuksen ympärille, joka koostuu näistä proteiineista, jotka ovat läheisessä vuorovaikutuksessa keskenään. Histonikeskuksessa on levyn muoto ja DNA antaa noin 1,7 kierrosta sen ympärille.
Useat vedyn sidokset mahdollistavat DNA: n sitoutumisen proteiinikeskukseen, jonka histonit muodostavat kussakin nukleosomissa. Nämä sidokset muodostuvat enimmäkseen histonien aminohapon luurankojen ja DNA: n sokerifosfaatti- rungon välillä. Mukana on myös joitakin hydrofobisia vuorovaikutuksia ja ionisia sidoksia.
Proteiinit, jotka tunnetaan nimellä "kromatiini remodeling komplekseja", ovat vastuussa DNA: n ja histonien välisten sitoutumis- sidosten hajoamisesta ja muodostumisesta, mikä mahdollistaa transkription koneen pääsyn nukleosomeihin sisältyvään DNA: han.
Läheisyydestä huolimatta nukleiinihappojen proteiiniin koostuva ydin, histonien, nämä on järjestetty siten, että tarvittaessa, jotta tulo transkriptiotekijöiden ja muut liittyvät ilmentymisen tai geenin hiljentäminen proteiineja.
Histonit voivat käydä läpi erilaisia modifikaatioita, jotka tuottavat useita variantteja, mikä mahdollistaa monien eri kromatiinin muotojen olemassaolon, joilla on ominaisuus, joka moduloi geenien ilmentymistä eri tavoin.
indeksi
- 1 Ominaisuudet
- 2 Rakenne
- 2.1 Unionin histonit
- 3 tyyppiä
- 3.1 Nukleosomaaliset histonit
- 3.2 Unionin histonit
- 4 Toiminnot
- 5 Viitteet
piirteet
Ne ovat luonnossa eniten säilytettyjä eukaryoottisia proteiineja. Esimerkiksi on osoitettu, että herne-histoni H4 eroaa vain kahdessa lehmän proteiinin H4 102 aminohappopositiosta..
Histonit ovat suhteellisen pieniä proteiineja, joissa on enintään 140 aminohappoa. Ne ovat runsaasti emäksisissä aminohappotähteissä, joten niillä on positiivinen nettovaraus, joka edistää niiden vuorovaikutusta negatiivisesti varautuneen nukleiinihapon kanssa muodostamaan nukleosomeja.
Tunnetaan nukleosomaalisia ja yhdistäviä tai silloitettuja histoneja. Nukleosomaaliset histonit ovat H3, H4, H2A ja H2B, kun taas sitovat histonit kuuluvat H1-histoniperheeseen.
Nukleosomin kokoamisen aikana spesifiset dimeerit H3-H4 ja H2A-H2B muodostetaan aluksi. Kaksi H3-H4-dimeeriä yhdistetään sitten muodostaen tetrameerejä, jotka yhdistetään myöhemmin H2A-H2B-dimeereihin, muodostaen oktameerisen keskuksen.
Kaikki histonit syntetisoidaan pääasiassa solusyklin S-vaiheen aikana, ja nukleosomit kootaan nascent-DNA-heliksiin juuri replikaatiotangon jälkeen..
rakenne
Histonien yleinen rakenne sisältää emäksisen aminohapon alueen ja erittäin konservoituneen globaali karboksyylialueen eukaryoottisten organismien joukossa.
Rakenteellinen motiivi tunnetaan nimellä "histoni kertaiseksi", koostuu kolmesta alfaheliksiä ja kaksi iestä on yhdistetty muodostamalla pieni hydrofobinen keskus, vastaa proteiini-proteiini-vuorovaikutuksia histonien muodostavien nukleosomin.
Juuri tämä histonien kerros muodostaa mainittujen nukleosomaalisten proteiinien globulaarisen karboksyylidomeenin kaikissa eukaryooteissa.
Histonit sisältävät myös pieniä "hännän" tai aminopäätelaitteita ja muita karboksyyliterminaalisia alueita (pääsy proteaaseille), joiden pituus on enintään 40 aminohappoa. Molemmat alueet sisältävät runsaasti emäksisiä aminohappoja, jotka voivat läpäistä useita translaation jälkeisiä kovalenttisia modifikaatioita.
Unionin histonit
Eukaryooteilla on kaksi liiton histonien perhettä, jotka on erotettu niiden rakenteesta. Joillakin on kolmiosainen rakenne, jossa edellä kuvattua globulaarista domeenia ympäröivät N- ja C-terminaaliset "rakenteettomat" domeenit; toisilla on vain C-terminaalinen verkkotunnus.
Vaikka useimmat histonit ovat konservoituneita, jotkut spesifiset variantit voivat syntyä alkionmuodostuksen aikana tai erikoistuneiden solujen kypsymisen aikana joissakin organismeissa. Joillakin rakenteellisilla muunnelmilla on merkitystä muun muassa seuraavien muutosten jälkeen:
-fosforylaatio: sen uskotaan liittyvän kromatiinin kondensaatiotason muutokseen ja se on yleisesti seriinitähteissä.
-asetylointi: liittyy kromosomaalisiin alueisiin, jotka ovat transkriptionaalisesti aktiivisia. Se tapahtuu yleensä lysiinitähteiden sivuketjuissa. Kun näitä jäämiä esiintyy, positiivinen varaus pienenee, mikä vähentää proteiinien affiniteettia DNA: n kanssa.
-metylaatio: voidaan antaa proteiinisydämestä ulkonevien lysiinitähteiden mono-, di- tai tri- metyyliksi.
Spesifiset entsyymit ovat vastuussa näiden kovalenttisten modifikaatioiden tekemisestä histoneissa. Näitä entsyymejä ovat histoniasetyylitransferaasit (HAT), histoni-deasetylaasikompleksit (HDAC: t) ja histoni-metyylitransferaasit ja demetylaasit..
tyyppi
Histonien karakterisointi on toteutettu monipuolisilla biokemiallisilla tekniikoilla, joiden joukosta erottuvat kromatografiat, jotka perustuvat heikoihin kationinvaihtohartseihin.
Jotkut tekijät luovat luokitusmenetelmän, jossa 5 päätyyppiä histoneista erottuu eukaryooteissa: FI, 21 kDa: n proteiineilla; F2A1 tai FIV, plus tai miinus 11,3 kDa; F2A2 tai FIIbI, 14,5 kDa; F2B tai FIIb2, joiden molekyylipaino on 13,7 kDa, ja F3 tai FIII, 15,3 kDa.
Kaikki nämä histonityypit, lukuun ottamatta FI-ryhmää, löytyvät ekvimolaarisista määristä soluissa.
Toinen luokitus, jolla on sama voima ja ehkä käytetään nykyään, ehdottaa, että on olemassa kaksi erilaista histonien, eli ne, jotka ovat osa oktameeriä nukleosomeihin ja histonin sitova tai silta, joka yhdistää nukleosomit välillä kyllä.
Jotkut variantit voivat myös esiintyä lajien välillä ja toisin kuin ydinhistonien, variantit syntetisoidaan aikana välifaasi ja työnnetään kromatiinin esimuodostettu läpi prosessin riippuvainen vapautuvaa energiaa ATP hydrolyysin.
Nukleosomaaliset histonit
Nukleosomin ytimen muodostavat parin kustakin neljästä konstitutiivisesta histonista: H2a, H2b, H3 ja H4; joiden ympärille on kääritty noin 145 emäsparin DNA-segmentit.
Histonit H4 ja H2B ovat periaatteessa muuttumattomia. Jotkut variaatiot ovat kuitenkin ilmeisiä histoneissa H3 ja H2A, joiden biofyysiset ja biokemialliset ominaisuudet muuttavat nukleosomin normaalia luonnetta..
Histonin H2A: n muunnelmassa ihmisissä, H2A.Z-proteiinissa on suuri happama alue ja se voi edistää nukleosomin stabiilisuutta riippuen histoni-H3-variantista, joihin se liittyy.
Nämä histonit osoittavat jonkinlaista vaihtelua lajien välillä, mikä on erityinen histoni H2B: n tapaus, jolle molekyylin ensimmäinen kolmasosa on hyvin vaihteleva.
Unionin histonit
Risteys tai sillan histonit ovat luokan H1 histoneja. Nämä ovat vastuussa nukleosomien ja DNA-suojan välisestä liitosta, joka ulottuu kunkin partikkelin alkuun ja loppuun.
Toisin kuin nukleosomaaliset histonit, kaikilla tyypin H1 histoneilla ei ole histonien "taittuman" globulaarista aluetta. Nämä proteiinit sitoutuvat nukleosomien väliseen DNA: han, mikä helpottaa kromatiinin tasapainon muutosta kohti kondensoitunutta ja vähemmän aktiivista tilaa, transkriptionaalisesti puhuttaessa.
Tutkimukset ovat liittäneet nämä histonit ikääntymiseen, DNA: n korjaamiseen ja apoptoottisiin prosesseihin, joten niiden uskotaan olevan keskeinen rooli genomin eheyden ylläpitämisessä.
tehtävät
Kaikki histonien aminohappotähteet osallistuvat tavalla tai toisella vuorovaikutuksessa DNA: n kanssa, mikä selittää sen, että ne ovat niin konservoituneita eukaryoottisten organismien valtakuntien kesken.
Osallistuminen histonien DNA muotoiset pakkaukset kromatiinin on erittäin merkityksellisiä monimutkaisia monisoluisista organismeista, jossa eri solulinjoja voidaan erikoistuneet vain muuttamalla saatavuutta niiden geenien transkription koneet.
Transkriptionaalisesti aktiiviset genomiset alueet ovat tiheitä nukleosomeissa, mikä viittaa siihen, että DNA: n liittyminen histoniproteiineihin on ratkaisevan tärkeää niiden transkription negatiiviselle tai positiiviselle säätelylle.
Samoin koko elämän solu reagoi moniin ärsykkeisiin, sekä sisäisiä että ulkoisia, se riippuu pieniä muutoksia kromatiiniympäristössään, mikä yleensä on tekemistä remontin ja posttranslational muuttaminen histoneista löytyy läheinen suhde DNA:.
Useat histonimuuttujat käyttävät eukaryooteissa erilaisia toimintoja. Yksi niistä liittyy histonin H3: n muunnelman osallistumiseen centromeeristen rakenteiden muodostumiseen, jotka ovat vastuussa kromosomien erottumisesta mitoosin aikana.
On osoitettu, että tämän proteiinin vastine muissa eukaryooteissa on välttämätön proteiinin kinetokoreen kokoamiseksi, johon karan mikrotubulit sitoutuvat mitoosin ja meioosin aikana..
viittaukset
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., ja Walter, P. (2015). Solun molekyylibiologia (6. painos). New York: Garland Science.
- Campos, E. I., ja Reinberg, D. (2009). Histonit: kromatiinin merkitseminen. Annu. Genet., 43, 559 - 599.
- Harvey, A. C., ja Downs, J. A. (2004). Mitkä toiminnot tarjoavat linkkerihistoneja? Molecular Microbiology, 53, 771-775.
- Henikoff, S., & Ahmad, K. (2005). Variantit Histonien kokoonpano kromatiiniin. Annu. Cell. Dev. Biol., 21, 133-153.
- Isenberg, I. (1979). Histonit. Annu. Biochem., 48, 159 - 191.
- Kornberg, R. D., & Thomas, J. O. (1974). Kromatiinin rakenne: Histonien oligomeerit. Science, 184 (4139), 865-868.
- Smith, E., DeLange, R. & Bonner, J. (1970). Histonien kemia ja biologia. Fysiologiset arviot, 50 (2), 159-170.


