Sokerien pelkistysmenetelmät, tärkeys
pelkistävät sokerit ne ovat biomolekyylejä, jotka toimivat pelkistysaineina; eli he voivat lahjoittaa elektroneja toiselle molekyylille, johon he reagoivat. Toisin sanoen pelkistävä sokeri on hiilihydraatti, joka sisältää sen rakenteessa karbonyyliryhmän (C = O).
Tämä karbonyyliryhmä muodostuu hiiliatomista, joka on kiinnittynyt happiatomiin kaksoissidoksen kautta. Tämä ryhmä löytyy eri asemista sokerimolekyyleissä, mikä johtaa muihin funktionaalisiin ryhmiin, kuten aldehydeihin ja ketoneihin.
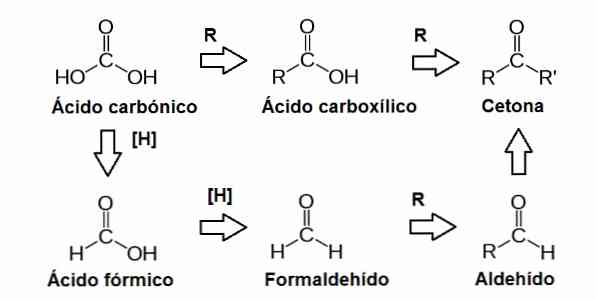
Aldehydit ja ketonit löytyvät yksinkertaisten sokerien tai monosakkaridien molekyyleistä. Nämä sokerit luokitellaan ketooseiksi, jos niillä on molekyylin sisällä oleva karbonyyliryhmä (ketoni) tai aldooseissa, jos ne sisältävät sen terminaalisessa asemassa (aldehydi).
Aldehydit ovat funktionaalisia ryhmiä, jotka voivat suorittaa hapetus-pelkistysreaktioita, joihin liittyy elektronien liikkuminen molekyylien välillä. Hapetus tapahtuu, kun molekyyli menettää yhden tai useamman elektronin ja pelkistyy, kun molekyyli saa yhden tai useamman elektronin.
Hiilihydraattien tyypeistä monosakkaridit ovat kaikki pelkistäviä sokereita. Esimerkiksi glukoosi, galaktoosi ja fruktoosi toimivat pelkistysaineina.
Joissakin tapauksissa monosakkaridit ovat osa suurempia molekyylejä, kuten disakkarideja ja polysakkarideja. Tästä syystä jotkut disakkaridit - kuten maltoosi - toimivat myös pelkistävinä sokereina.
indeksi
- 1 Menetelmät pelkistävien sokereiden määrittämiseksi
- 1.1 Benedict-testi
- 1.2 Fehling-reagenssi
- 1.3 Tollens reagenssi
- 2 Tärkeys
- 2.1 Lääketieteen merkitys
- 2.2 Maillard-reaktio
- 2.3 Elintarvikkeiden laatu
- 3 Pelkistävien sokerien ja ei-pelkistävien sokerien välinen ero
- 4 Viitteet
Menetelmät pelkistävien sokereiden määrittämiseksi
Benedictin testi
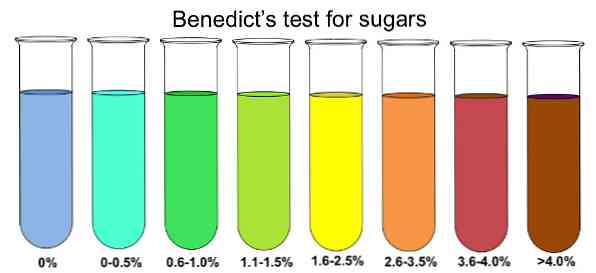
Pelkistävien sokerien läsnäolon määrittämiseksi näytteessä se liukenee kiehuvaan veteen. Seuraavaksi lisätään pieni määrä Benedictin reagenssia ja liuoksen annetaan saavuttaa huoneenlämpötila. Seuraavan 10 minuutin aikana ratkaisun pitäisi alkaa muuttua väriä.
Jos väri muuttuu siniseksi, ei ole olemassa pelkistäviä sokereita, erityisesti glukoosia. Jos analysoitavassa näytteessä on suuri määrä glukoosia, väri muuttuu vihreäksi, keltaiseksi, oranssiksi, punaiseksi ja lopulta ruskeaksi.
Benedictin reagenssi on useiden yhdisteiden seos: se sisältää vedetöntä natriumkarbonaattia, natriumsitraattia ja kupari (II) sulfaattipentahydraattia. Kun liuos on lisätty näytteeseen, oksidin vähentämisen mahdolliset reaktiot alkavat.
Jos on olemassa pelkistäviä sokereita, nämä vähentävät Benedictuksen liuoksen kuparisulfaattia (sininen väri) kuparisulfidiksi (punertava väri), joka näyttää saostumalta ja vastaa värinmuutoksesta.
Ei-pelkistävät sokerit eivät voi tehdä tätä. Tämä erityinen testi antaa vain kvalitatiivisen käsityksen pelkistävien sokerien läsnäolosta; se tarkoittaa, että se osoittaa, onko näytteessä pelkistäviä sokereita.
Fehlingin reagenssi
Samoin kuin Benedictin testi, Fehling-testi edellyttää, että näyte on liuennut kokonaan; Tämä tehdään lämmön läsnä ollessa sen varmistamiseksi, että se liukenee kokonaan. Tämän jälkeen Fehling-liuosta lisätään jatkuvasti sekoittaen.
Jos esiintyy pelkistäviä sokereita, liuoksen tulee alkaa muuttua värin oksidina tai punainen sakka. Jos pelkistäviä sokereita ei ole, liuos säilyy sinisenä tai vihreänä. Fehling-liuos valmistetaan myös kahdesta muusta liuoksesta (A ja B).
Liuos A sisältää veteen liuotettua kupari (II) sulfaattipentahydraattia ja liuos B sisältää kalium natriumtartraattitetrahydraattia (Rochellen suolaa) ja natriumhydroksidia vedessä. Nämä kaksi liuosta sekoitetaan tasa-arvoisina osina lopullisen testiliuoksen valmistamiseksi.
Tätä testiä käytetään monosakkaridien, erityisesti aldoosien ja ketoosien, määrittämiseen. Nämä havaitaan, kun aldehydi hapetetaan hapoksi ja muodostaa kuparioksidin.
Aldehydiryhmän kanssa kosketuksen jälkeen se pelkistetään kupari-ioniksi, joka muodostaa punaisen sakan ja osoittaa pelkistävien sokerien läsnäolon. Jos näytteessä ei ollut pelkistäviä sokereita, liuos pysyisi sinisenä, mikä osoittaa negatiivisen tuloksen tästä testistä..
Tollens-reagenssi
Tollens-testi, joka tunnetaan myös nimellä hopean peili, on kvalitatiivinen laboratoriotesti, jota käytetään erottamaan aldehydi ja ketoni. Se hyödyntää sitä tosiasiaa, että aldehydit hapettuvat helposti, kun taas ketonit eivät.
Tollens-testissä käytetään seosta, joka tunnetaan nimellä Tollens-reagenssi, joka on emäksinen liuos, joka sisältää ammoniakin kanssa koordinoituja hopeaioneja..
Tämä reagenssi ei ole kaupallisesti saatavilla sen lyhyen käyttöiän vuoksi, joten se on valmistettava laboratoriossa, kun sitä aiotaan käyttää.
Reagenssin valmistukseen kuuluu kaksi vaihetta:
Vaihe 1
Vesipitoinen hopeanitraatti sekoitetaan natriumhydroksidin vesiliuokseen.
Vaihe 2
Lisätään tipoittain vesipitoista ammoniakkia, kunnes saostunut hopeaoksidi liukenee kokonaan.
Tollens-reagenssi hapettaa aldehydit, jotka ovat läsnä vastaavissa pelkistävissä sokereissa. Sama reaktio sisältää Tollens-reagenssin hopeaionien pelkistämisen, joka muuntaa ne metalliseksi hopeaksi. Jos testi suoritetaan puhtaassa koeputkessa, muodostuu hopean saostuma.
Näin ollen positiivinen tulos Tollens-reagenssilla määritetään tarkkailemalla "hopeapeili" koeputken sisällä; tämä peilivaikutus on tämän reaktion ominaispiirre.
tärkeys
Pelkistävien sokerien läsnäolon määrittäminen eri näytteissä on tärkeää useissa näkökohdissa, joihin kuuluvat lääketiede ja gastronomia.
Merkitys lääketieteessä
Pelkistävien sokereiden seulontatestejä on käytetty vuosia diabeteksen potilaiden diagnosoimiseksi. Tämä voidaan tehdä, koska tälle taudille on ominaista veren glukoosipitoisuuksien nousu, jolloin näiden määrittäminen voidaan suorittaa näillä hapetusmenetelmillä.
Mittaamalla glukoosilla pelkistetyn hapettavan aineen määrää on mahdollista määrittää glukoosin pitoisuus veri- tai virtsanäytteissä.
Tämä antaa potilaalle mahdollisuuden osoittaa sopiva määrä insuliinia, joka on annettava, jotta veren glukoosipitoisuudet palautuvat normaalialueelle.
Maillardin reaktio
Maillard-reaktiossa on joukko monimutkaisia reaktioita, joita esiintyy joidenkin elintarvikkeiden valmistuksessa. Kun elintarvikkeen lämpötila kasvaa, pelkistävien sokerien karbonyyliryhmät reagoivat aminohappojen aminoryhmien kanssa.
Tämä keittoreaktio tuottaa erilaisia tuotteita, ja vaikka monet ovat hyödyllisiä terveydelle, toiset ovat myrkyllisiä ja jopa syöpää aiheuttavia. Tästä syystä on tärkeää tietää normaaliin ruokavalioon sisältyvien pelkistävien sokereiden kemia.
Maillard-reaktioita esiintyy ruoanvalmistuksessa, jossa on runsaasti tärkkelysperäisiä perunoita - erittäin korkeissa lämpötiloissa (yli 120 ° C).
Tämä reaktio tapahtuu aminohappojen asparagiinin ja pelkistävien sokerien välillä, jolloin muodostuu akryyliamidin molekyylejä, joka on neurotoksiinia ja mahdollinen syöpää aiheuttava aine..
Elintarvikkeiden laatu
Tiettyjen elintarvikkeiden laatua voidaan seurata pelkistävien sokereiden havaitsemismenetelmillä. Esimerkiksi viineihin, mehuihin ja sokeriruokoon pelkistävien sokerien määrä määritetään tuotteen laadun osoittamiseksi..
Pelkistävien sokerien määrittämiseksi elintarvikkeessa Fehling-reagenssia, jossa on metyleenisinistä, käytetään normaalisti oksidien pelkistysindikaattorina. Tämä muutos tunnetaan yleisesti Lane-Eynonin menetelmänä.
Pelkistävien sokerien ja ei-pelkistävien sokerien välinen ero
Pelkistävien ja ei-pelkistävien sokerien välinen ero on niiden molekyylirakenteessa. Hiilihydraatit, jotka vähentävät muita molekyylejä, luovuttavat elektroneja vapaista aldehydi- tai ketoniryhmistään.
Siksi ei-pelkistävillä sokereilla ei ole rakenteissaan aldehydejä tai vapaita ketoneja. Näin ollen ne antavat negatiivisia tuloksia pelkistävien sokereiden havaintokokeissa, kuten Fehling- tai Benedict-testissä.
Pelkistävät sokerit käsittävät kaikki monosakkaridit ja jotkut disakkaridit, kun taas ei-pelkistävät sokerit sisältävät joitakin disakkarideja ja kaikkia polysakkarideja.
viittaukset
- Benedict, R. (1907). SOKERIEN VÄHENTÄMINEN JA ARVIOINTI. Journal of Biological Chemistry, 3, 101-117.
- Berg, J., Tymoczko, J., Gatto, G. & Strayer, L. (2015). biokemia (8. painos). W. H. Freeman ja Company.
- Chitvoranund, N., Jiemsirilers, S., & Kashima, D. P. (2013). Pintakäsittelyn vaikutukset hopeakalvon tarttumiseen Electroless Platingin valmistamaan lasialustaan. Australian keramiikkayhdistyksen lehti, 49(1), 62-69.
- Hildreth, A., Brown, G. (1942). Lane-Eynonin menetelmän muokkaaminen sokerin määrittämiseksi. Virallisten analyyttisten kemikaalien liitto 25 (3): 775 - 778.
- Jiang, Z., Wang, L., Wu, W. & Wang, Y. (2013). Maillard-reaktiotuotteiden biologiset vaikutukset ja fysikaalis-kemialliset ominaisuudet sokeripitoisissa kaseiinipeptidimallijärjestelmissä. Elintarvikekemia, 141(4), 3837-3845.
- Nelson, D., Cox, M. & Lehninger, A. (2013). Lehningerin biokemian periaatteet (6th). W.H. Freeman ja Company.
- Pedreschi, F., Mariotti, M.S., & Granby, K. (2014). Akryyliamidin nykyiset kysymykset: muodostuminen, lieventäminen ja riskien arviointi. Journal of Food of Food ja maatalous, 94(1), 9-20.
- Rajakylä, E., & Paloposki, M. (1983). Sokerien (ja betaiinin) määrittäminen melassissa korkean suorituskyvyn nestekromatografialla. Journal of Chromatography, 282, 595-602.
- Scales, F. (1915). SOKERIEN VÄHENTÄMINEN. The Journal of Ciological Chemistry, 23, 81-87.
- Voet, D., Voet, J. & Pratt, C. (2016). Biokemian perusteet: Elämä molekyylitasolla(5. painos). Wiley.


