Atominen tilavuus Miten se vaihtelee jaksollisessa taulukossa ja esimerkeissä
atomitilavuus on suhteellinen arvo, joka ilmaisee elementin moolimassan ja sen tiheyden välisen suhteen. Niinpä tämä tilavuus riippuu elementin tiheydestä, ja tiheys riippuu vuorostaan vaiheesta ja siitä, miten atomit on järjestetty tässä.
Siten Z-elementin atomitilavuus ei ole sama toisessa vaiheessa kuin se, joka on huoneenlämpötilassa (neste, kiinteä tai kaasu), tai kun se on osa tiettyjä yhdisteitä. Siten Z: n atomitilavuus yhdisteessä ZA on erilainen kuin Z: n yhdisteessä ZB.

Miksi? Sen ymmärtämiseksi on tarpeen verrata atomeja esimerkiksi marmorien kanssa. Marmorit, kuten ylemmän kuvan sinertävät, ovat hyvin määrittäneet materiaalinsa rajan, jota havaitaan sen loistavan pinnan ansiosta. Sitä vastoin atomien raja on diffuusi, vaikkakin niitä voidaan pitää etäisesti pallomaisina.
Niinpä se, mikä määrää atomirajan ylittävän pisteen, on elektronin löytymisnopeus, ja tämä piste voi olla kauempana tai lähempänä ydintä riippuen siitä, kuinka monta naapuriatomia vuorovaikutuksessa atomin ympärillä..
indeksi
- 1 Atomin tilavuus ja säde
- 2 Lisäkaava
- 3 Miten atomitilavuus vaihtelee jaksollisessa taulukossa?
- 3.1 Siirtymämetallien atomimäärät
- 4 Esimerkkejä
- 4.1 Esimerkki 1
- 4.2 Esimerkki 2
- 5 Viitteet
Atomin tilavuus ja säde
Toimimalla vuorovaikutuksessa kahden H-atomin kanssa H-molekyylissä2, niiden ytimien asemat määritellään sekä niiden väliset etäisyydet (ydinalan etäisyydet). Jos molemmat atomit ovat pallomaisia, säde on ytimen ja diffuusion välisen etäisyyden välinen etäisyys:
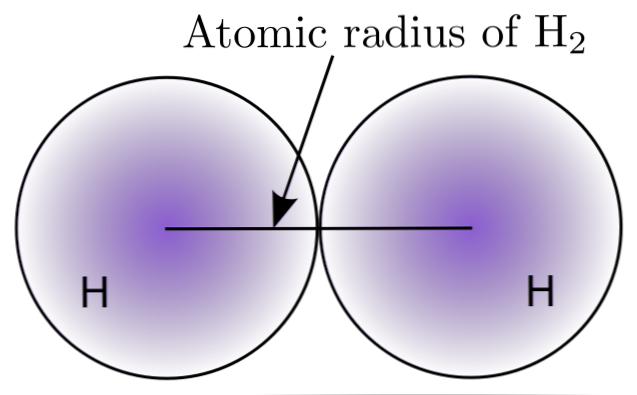
Ylemmässä kuvassa voidaan nähdä, miten todennäköisyys löytää elektroni pienenee, kun se siirtyy pois ytimestä. Jakamalla kahden ydinvoiman välinen etäisyys saadaan atomi- säde. Seuraavaksi, olettaen atomien pallomainen geometria, käytämme kaavaa laskemaan pallon tilavuus:
V = (4/3) (Pi) r3
Tässä lausekkeessa r on H-molekyylille määritetty atomisäde2. Tällä epätarkalla menetelmällä laskettu V-arvo voi muuttua, jos esimerkiksi sitä pidettiin H: nä2 nestemäisessä tai metallisessa tilassa. Tämä menetelmä on kuitenkin hyvin epätarkka, koska atomien muodot ovat kaukana ihanteellisesta alasta niiden vuorovaikutuksessa.
Kiinteän aineen atomitilavuuden määrittämiseksi otetaan huomioon monet järjestelyyn liittyvät muuttujat, ja ne saadaan röntgendiffraktiotutkimuksilla..
Lisämuoto
Moolimassa ilmaisee aineen määrän, jolla on yksi mooli kemiallisen elementin atomeja.
Sen yksiköt ovat g / mol. Toisaalta tiheys on tilavuus, joka vie yhden gramman elementtiä: g / ml. Koska atomitilavuusyksiköt ovat ml / mol, sinun täytyy pelata muuttujilla haluttujen yksiköiden saavuttamiseksi:
(g / mol) (ml / g) = ml / mol
Tai mikä on sama:
(Moolimassa) (1 / D) = V
(Moolimassa / D) = V
Täten elementin atomien yhden moolin tilavuus voidaan helposti laskea; kun taas pallomaisen tilavuuden kaavalla lasketaan yksittäisen atomin tilavuus. Tämän arvon saavuttamiseksi ensimmäisestä, muuntaminen on välttämätöntä Avogadron numeron (6.02 · 10) kautta.-23).
Miten atomitilavuus vaihtelee jaksollisessa taulukossa?
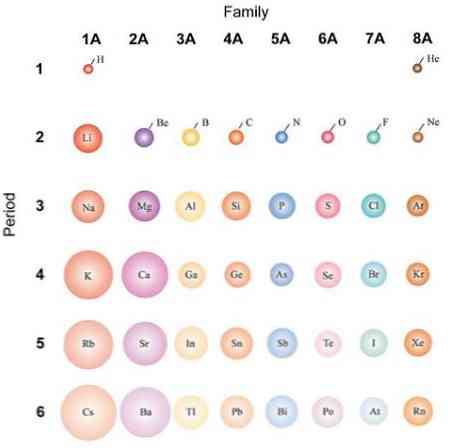
Jos atomeja pidetään pallomaisina, niiden vaihtelu on sama kuin atomiradioissa havaittu. Ylemmässä kuvassa, joka esittää edustavia elementtejä, on havainnollistettu, että oikealta vasemmalle atomien kääpiö; sen sijaan ylhäältä alaspäin ne tulevat laajemmiksi.
Tämä johtuu siitä, että samassa jaksossa ydin sisältää protoneja, kun se liikkuu oikealle. Nämä protonit käyttävät houkuttelevaa voimaa ulkoisille elektroneille, jotka tuntevat tehokkaan ydinvaraus Z: neff, vähemmän kuin todellinen ydinmaksu Z.
Sisäkerrosten elektronit hylkivät ulomman kerroksen ne, jotka vähentävät ytimen vaikutusta näihin; Tätä kutsutaan näytön vaikutukseksi. Samana ajanjaksona näytön vaikutus ei onnistu torjumaan protonien määrän kasvua, joten sisäkerroksen elektronit eivät estä atomien supistumista.
Kuitenkin laskemalla ryhmään uudet energiatasot ovat mahdollisia, jolloin elektronit voivat kiertää kauempana ytimestä. Myös elektronien lukumäärä sisäkerroksessa kasvaa, ja niiden suojausvaikutukset alkavat pienentyä, jos ydin lisää protoneja.
Näistä syistä voidaan nähdä, että ryhmällä 1A on eniten tilavia atomeja, toisin kuin ryhmän 8A (tai 18) pienet atomit, jaloilla kaasuilla..
Siirtymämetallien atomimäärät
Siirtymämetallien atomit sisältävät elektronit sisäisiin orbitaaleihin d. Tämä näytön vaikutuksen ja todellisen ydinmaksun Z lisääntyminen peruutetaan lähes yhtä paljon, niin että niiden atomit säilyttävät samanlaisen koon samana ajanjaksona.
Toisin sanoen: yhdellä kaudella siirtymämetallit osoittavat samanlaiset atomitilavuudet. Nämä pienet erot ovat kuitenkin huomattavan merkittäviä metalli- kiteitä määritettäessä (ikään kuin ne olisivat metallisia marmoreita).
esimerkit
Käytettävissä on kaksi matemaattista kaavaa elementin atomitilavuuden laskemiseksi, joista jokaisella on vastaavat esimerkit.
Esimerkki 1
Kun otetaan huomioon vetyatomin säde -37 pm (1 pikometri = 10)-12m) - ja cesium -265 pm - laskevat sen atomimäärät.
Käyttämällä pallomaisen tilavuuden kaavaa meillä on:
VH= (4/3) (3.14) (37 pm)3= 212,07 pm3
Vcs= (4/3) (3.14) (265 pm)3= 77912297,67 pm3
Kuitenkin pyrometreissä ilmaistut tilavuudet ovat liiallisia, joten ne muunnetaan angströmien yksiköiksi kertomalla ne muuntokertoimella (1 / 100pm)3:
(212.07 pm3) (1 / 100pm)3= 2,1207 × 10-4 Å3
(77912297,67 pm3) (1 / 100pm)3= 77,912 Å3
Siten H: n pienen atomin ja Cs: n ison atomin väliset koon erot pysyvät numeerisesti ilmeisinä. On pidettävä mielessä, että nämä laskelmat ovat vain likiarvoja väitteen mukaan, että atomi on täysin pallomainen, joka kulkee todellisuuden edessä..
Esimerkki 2

Puhtaan kullan tiheys on 19,32 g / ml ja sen moolimassa on 196,97 g / mol. Kaavan M / D käyttäminen yhden moolin kulta-atomien määrän laskemiseen on seuraava:
Vau= (196,97 g / mol) / (19,32 g / ml) = 10,19 ml / mol
Toisin sanoen 1 mooli kulta-atomia vie 10,19 ml: aan, mutta mikä määrä kulta-atomia on nimenomaan? Ja miten ilmaista se yksikköinä pm3? Käytä yksinkertaisesti seuraavia muuntokertoimia:
(10,19 ml / mol) · (mol / 6,02 · 10)-23 atomit) · (1 m / 100 cm)3· (1 pm / 10-12m)3= 16,92 · 106 pm3
Toisaalta kultaisen atomin säde on 166 pm. Jos verrataan molempia määriä - edellisen menetelmän avulla saatuja ja sfäärisen äänen kaavalla laskettua -, näet, että niillä ei ole samaa arvoa:
Vau= (4/3) (3,14) (166 pm)3= 19,15 · 106 pm3
Kumpi näistä kahdesta on lähinnä hyväksyttyä arvoa? Se, joka on lähinnä kullan kiteisen rakenteen röntgendiffraktiolla saatuja kokeellisia tuloksia.
viittaukset
- Helmenstine, Anne Marie, Ph.D. (09.12.2017). Atomic Volume Definition. Haettu 6. kesäkuuta 2018 osoitteesta thinkco.com
- Mayfair, Andrew. (13. maaliskuuta 2018). Miten lasketaan atomin tilavuus. sciencing. Haettu 6. kesäkuuta 2018 alkaen: sciencing.com
- Wiki Kids Oy (2018). Lothar Meyer Atomic Volume Curves. Haettu 6. kesäkuuta 2018 osoitteesta: wonderwhizkids.com
- Lumen. Säännölliset trendit: Atomi-säde. Haettu 6. kesäkuuta 2018 alkaen osoitteesta courses.lumenlearning.com
- Camilo J. Derpich. Äänenvoimakkuus ja atomitiheys. Haettu 6. kesäkuuta 2018 alkaen: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. Kemia. (8. painos). CENGAGE Learning, s. 222-224.
- CK-12 Säätiö. (22. helmikuuta 2010). Vertailevat atomikoot. [Kuva]. Haettu 6. kesäkuuta 2018 osoitteesta: commons.wikimedia.org
- CK-12 Säätiö. (22. helmikuuta 2010). H: n atomiradio2. [Kuva]. Haettu 6. kesäkuuta 2018 osoitteesta: commons.wikimedia.org


