Natriumsulfaatin kaava, ominaisuudet, rakenne, sovellukset
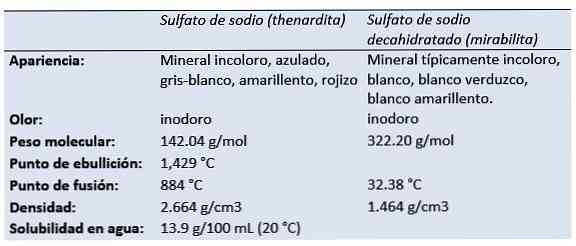
natriumsulfaatti (rikkihapon dinatriumsuola, dinatriumtetraoksidosulfaatti, natriumsulfaatti, Glauberin suola, sitten sardiitti, mirabiliitti) on epäorgaaninen yhdiste, jolla on kaava Na2SW4 ja siihen liittyvät hydraatit. Kaikki muodot ovat valkoisia kiinteitä aineita, jotka liukenevat hyvin veteen.
Sitä pidetään yhtenä tärkeimmistä kemikaaleista, joita markkinoidaan. Sen maailmanlaajuinen tuotanto (lähes yksinomaan dekahydraattina) on noin 6 miljoonaa tonnia vuodessa.

Silloin on vedetön natriumsulfaatin mineraali, joka on tuotettu kuivissa haihtuvissa ympäristöissä, kuivissa luolissa, vanhoissa kaivostoiminnoissa kiteytyneenä, ja talletuksena fumaroleiden ympärillä..
Sitä kuvattiin ensin vuonna 1825 Salinas Espartinassa (Ciempozuelos, Madrid, Espanja) ja nimettiin sitten willarditaksi Ranskan kemisti Louis Jacques Thénardin (1777-1826) kunniaksi..

Hollanti / saksalainen kemisti ja apteekkari Johann Rudolf Glauber (1604-1670) löysivät vuonna 1625 itävaltalaisen kevään vedessä, natriumsulfaatti-dekahydraatissa (joka myöhemmin tunnetaan nimellä Glauberin suola). Hän kutsui sitä mirabilis-suolaksi (ihmeellinen suola) sen lääkinnällisten ominaisuuksien vuoksi.
Vuosina 1650–1660 Glauber alkoi valmistaa natriumsulfaattia tavallisesta suolasta (NaCl) ja väkevästä rikkihaposta. Tätä prosessia pidetään kemianteollisuuden alussa.
Sen kiteitä käytettiin laksatiivina 20-luvulle saakka.
1800-luvulla Glauberin suolan ja kaliumkarbonaatin reaktiota alkoi käyttää natriumkarbonaatin (natriumkarbonaatin) teollisessa tuotannossa..

Sitä käytetään tällä hetkellä pääasiassa pesuaineiden valmistukseen ja Kraft-prosessiin paperimassan tuottamiseen (hallitseva menetelmä paperin valmistuksessa).
Natriumsulfaattimineraalit ovat Yhdysvalloissa, Kanadassa, Espanjassa, Italiassa, Turkissa, Romaniassa, Meksikossa, Botswanassa, Kiinassa, Egyptissä, Mongoliassa ja Etelä-Afrikassa..
Tärkeimmät tuottajat ovat Kiina (Jiangsun ja Sichuanin maakunnat), jota seuraa Espanja, jossa maailman suurin glauberiittipaikka sijaitsee (Cerezo de Río Tirónissa, Burgosissa).
Maailman luonnollisen natriumsulfaatin tuotannon arvioidaan olevan noin 8 miljoonaa tonnia ja muiden teollisten prosessien sivutuotteena 2–4 miljoonaa tonnia..
Espanjassa kansallisen natriumsulfaattiresurssien luettelossa ja muissa päivitetyissä tiedoissa julkaistujen tietojen mukaan arviolta 730 Mt: n suuruiset natriumsulfaattimineraalien varastot luokitellaan "varauksiin" ja 300 Mt luetteloitiin "muiksi resursseiksi"..
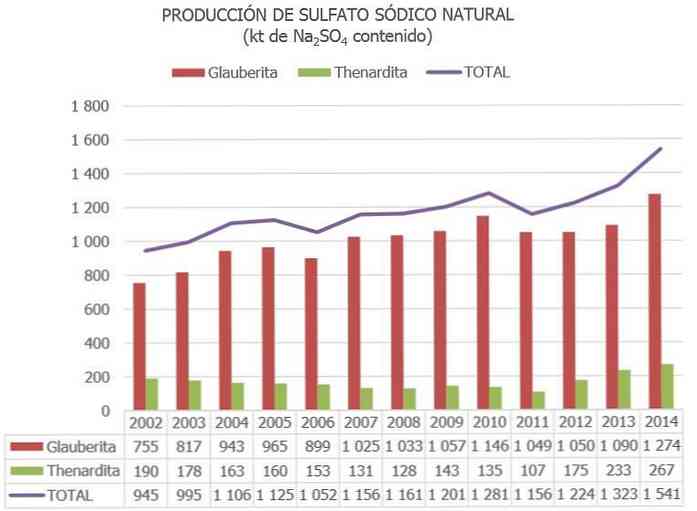
Euroopan unionissa Espanja on tällä hetkellä ainoa maa, jossa on natriumsulfaattimalmia (pääasiassa Thenardite, Glauberite ja Mirabilite).
Tällä hetkellä tekstiilialan natriumsulfaatin kysyntä on yleisesti laskenut.
Viime vuosina muilla aloilla, kuten pesuaineissa, on ollut jonkin verran kasvua joillakin alueilla niiden alhaisen raaka-ainehinnan vuoksi.
Natriumsulfaatin pesuaineiden tärkeimmät laajenevat markkinat ovat Aasiassa, Keski-Amerikassa ja Etelä-Amerikassa.
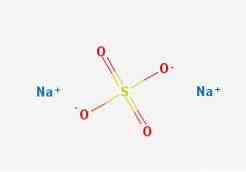
kaavat

2D-rakenne
3D-rakenne
piirteet
Fysikaaliset ja kemialliset ominaisuudet
Natriumsulfaatti kuuluu natriumyhdisteiden reaktiiviseen ryhmään ja kuuluu myös sulfaattien, vetysulfaattien ja disulfitien ryhmään.
syttyvyyttä
Se on palamaton aine. Sen jauheiden räjähdysvaara ei ole olemassa.
reaktiivisuus
Natriumsulfaatti on hyvin liukoinen veteen ja hygroskooppinen. Se on hyvin stabiili, se ei reagoi useimpiin hapettaviin tai pelkistäviin aineisiin normaaleissa lämpötiloissa. Korkeissa lämpötiloissa se voidaan muuntaa natriumsulfidiksi karbotermisellä pelkistyksellä.
Kemiallisesti reagoimattomia aineita pidetään reaktiivisina tyypillisissä ympäristöolosuhteissa (vaikka ne voivat reagoida suhteellisen äärimmäisissä olosuhteissa tai katalyysissä). Ne kestävät hapettumista ja vähentymistä (paitsi äärimmäisissä olosuhteissa).
Vaaralliset kemialliset reaktiot
Kun alumiini sulatetaan yhdessä natrium- tai kaliumsulfaatin kanssa, tapahtuu voimakas räjähdys.
myrkyllisyys
Kemiallisesti reagoimattomia aineita pidetään myrkyttöminä (vaikka tämän ryhmän kaasumaiset aineet voivat toimia tukahduttavina aineina).
Vaikka natriumsulfaattia pidetään yleensä myrkyttömänä, sitä on käsiteltävä huolellisesti. Jauhe voi aiheuttaa astmaa tai tilapäistä silmä-ärsytystä. Tämä riski voidaan välttää käyttämällä suojalaseja ja paperimaskia.
sovellukset
Sen tärkeimmät sovellukset ovat:
- pesuainejauhe.
- paperimassaa.
- tekstiilit.
- lasi.
- entsyymien synteesi (viininvalmistus).
- ihmisten ja eläinten ruokaa.
- apteekkituotteet.
- perustekemia yleensä.
- teräksen prosessit.
- Pesuainejauhe
Natriumsulfaatti on erittäin halpa materiaali. Sen suurin käyttö on kotitalouksien jauhemaisten pesuaineiden täyteaineena, joka kuluttaa n. 50% maailman tuotannosta. Uudet kompakti- tai nestemäiset pesuaineet eivät sisällä natriumsulfaattia, joten tämä käyttö vähenee.
Toinen natriumsulfaatin käyttö, jonka merkitys vähenee, erityisesti Yhdysvalloissa. ja Kanadassa, on Kraft-prosessissa puumassan valmistuksessa. Prosessin lämpötehokkuuden edistyminen pienensi merkittävästi natriumsulfaatin tarvetta.
Lasiteollisuus on toinen tärkeä sovellus natriumsulfaatille. Se on toiseksi suurin sovellus Euroopassa. Natriumsulfaattia käytetään poistamaan pienet ilmakuplat sulasta lasista.
Japanissa suurin natriumsulfaatin käyttö on tekstiilien valmistuksessa. Natriumsulfaatti auttaa väriaineita tunkeutumaan tasaisesti kuituihin ja ei korrodoi värjäykseen käytettyjä ruostumattomasta teräksestä valmistettuja astioita (toisin kuin natriumkloridi, mikä on vaihtoehtoinen menetelmä).
Natriumsulfaatti soveltuu erityisen hyvin huonolaatuisen aurinkolämmön (myöhempää vapautumista varten lämmityskäyttöön) varastoimiseksi, koska sen korkea lämmön varastointikapasiteetti on vaiheenvaihdossa kiinteästä nesteeseen, joka annetaan 32 ° C: ssa..
Jäähdytyskäyttöön seos, jossa on natriumkloridiliuosta (NaCl), vähentää sulamispistettä 18 ° C: seen.
Laboratoriossa vedetöntä natriumsulfaattia käytetään laajalti inerttiä kuivausainetta orgaanisten liuosten vesijäämien poistamiseksi. Sen vaikutus on hitaampi kuin magnesiumsulfaatilla, mutta sitä voidaan käyttää useiden eri materiaalien kanssa, koska se on kemiallisesti melko inertti.
Natriumsulfaattidekahydraattia (Glauberin suolaa) käytettiin historiallisesti laksatiivina. Se on tehokas eräiden lääkkeiden, kuten asetaminofeenin (asetaminofeenin) eliminoimiseksi elimistöstä yliannostuksen jälkeen..
Muita natriumsulfaattisovelluksia ovat sen käyttö lisäaineena mattoilmajäähdyttimien valmistuksessa kotieläinrehun lisäaineena ja tärkkelyksen valmistuksessa..
Kliiniset vaikutukset
Terapeuttisiin sovelluksiinsa natriumsulfaatti kuuluu suolaliuoksen ja katarisiin laksatiivien luokkaan, joita käytetään ummetuksen hoitoon..
Suolaliuokset ovat suoloja, jotka säilyttävät suolistossa nesteet imeytymättömän suolan osmoottisella vaikutuksella, jolloin peristaltiikka kasvaa epäsuorasti.
Suolalihakateet imeytyvät ruoansulatuskanavassa huonosti, joten systeeminen toksisuus on epätodennäköistä, ellei suuria määriä ole otettu. Suuret altistukset voivat kuitenkin aiheuttaa dehydraatiota ja elektrolyytin muutoksia, jotka ovat toissijaisia yhdisteen osmoottisiin vaikutuksiin nähden.
Kroonista laksatiivista väärinkäyttöä voi esiintyä potilailla, joilla on syömishäiriöitä, Munchausen-oireyhtymä tai tosiasiallisia häiriöitä. Yleensä potilaat kokevat pahoinvointia, oksentelua ja ripulia, jotka liittyvät vatsakouristukseen. Vakavia vaikutuksia voivat olla dehydraatio, hypotensio, hypernatremia ja elektrolyyttihäiriöt.
Turvallisuus ja riskit
Kemikaalien luokitusta ja merkintöjä koskevan maailmanlaajuisesti yhdenmukaistetun järjestelmän vaaratekijät (SGA).
Maailmanlaajuisesti yhdenmukaistettu kemikaalien luokitus- ja merkintäjärjestelmä (SGA) on Yhdistyneiden Kansakuntien kansainvälisesti sovittu järjestelmä, jonka tarkoituksena on korvata eri maissa käytettävät erilaiset luokitus- ja merkintävaatimukset yhdenmukaisilla maailmanlaajuisilla kriteereillä (Yhdistyneet Kansakunnat) United, 2015).
Vaaraluokat (ja niiden vastaava luku GHS: stä), luokitus- ja merkintästandardit sekä suositukset natriumsulfaattia varten ovat seuraavat (Euroopan kemikaalivirasto, 2017, Yhdistyneet Kansakunnat, 2015, PubChem, 2017):
GHS: n vaaraluokat
H315: Ärsyttää ihoa [Varoitus Ihosyövyttävyys / ärsytys - Kategoria 2].
H317: Voi aiheuttaa allergisen ihoreaktion [Varoitus herkistyminen, iho - luokka 1].
H319: Ärsyttää voimakkaasti silmiä [Varoitus Vakava silmävaurio / silmä-ärsytys - luokka 2A].
H412: Haitallista vesieliöille, joilla on pitkäaikaisia haittavaikutuksia [Vaarallinen vesiympäristölle, pitkäaikainen vaara - Luokka 3].
(PubChem, 2017)
Vakavaraisuusneuvostojen koodit
P261, P264, P272, P273, P280, P302 + P352, P305 + P351 + P338, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363 ja P501.
viittaukset
- ChemIDplus (2017) 3D-rakenne 7757-82-6 - vedetön natriumsulfaatti [kuva]. Haettu osoitteesta: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-rakenne 7727-73-3 - natriumsulfaatti [USP] [kuva]. Haettu osoitteesta: chem.nlm.nih.gov.
- Dyet, D. (2007) Thenardite natriumsulfaatti lähellä Sodaville Mineral County Nevada [image] Haettu osoitteesta en.wikipedia.org.
- Euroopan kemikaalivirasto (ECHA), (2017). Yhteenveto luokituksesta ja merkinnöistä. Yhdenmukaistettu luokitus - asetuksen (EY) N: o 1272/2008 (CLP-asetus) liite VI. Natriumsulfaatti.
- Grumetisho (2012) Mirabilita [kuva] Haettu osoitteesta es.wikipedia.org.
- Vaarallisten aineiden tietopankki (HSDB). TOXNET. (2017). Natriumsulfaatti Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta: toxnet.nlm.nih.gov.
- Espanjan geologinen ja kaivoslaitos (IGME) (2016). GLAUBERITA-THENARDITA (NATURAL SODIUM SULPHATE) 2014. Kaivospanoraama. Haettu osoitteesta igme.es.
- Kansallinen työturvallisuuslaitos (INSHT). (2010). Kansainväliset turvallisuustiedotteet. Natriumsulfaatti. Työ- ja turvallisuusministeriö. Madrid. Se on. Haettu osoitteesta insht.es.
- Langbein Rise (2008) Jatkuva kraft-massa [kuva] Haettu osoitteesta wikimedia.org.
- Yhdistyneet Kansakunnat (2015). Maailmanlaajuisesti yhdenmukaistettu järjestelmä kemiallisten tuotteiden luokitusta ja merkintöjä varten (SGA) Kuudes tarkistettu versio. New York, Yhdysvallat: Yhdistyneiden Kansakuntien julkaisu. Haettu osoitteesta unece.org.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound Database (2016) natriumsulfaatti - PubChem-rakenne [kuva] Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta pubchem.ncbi.nlm.nih.gov.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound Database (2016) natriumsulfaatti - PubChem-rakenne [kuva] Bethesda, MD, EU: Lääketieteellinen kirjasto.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound -tietokanta. (2017). Natriumsulfaatti dekahydratoitu. Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta pubchem.ncbi.nlm.nih.gov.
- Kansallinen bioteknologian tiedotuskeskus. PubChem Compound -tietokanta. (2017). Natriumsulfaatti Bethesda, MD, EU: Lääketieteellinen kirjasto. Haettu osoitteesta pubchem.ncbi.nlm.nih.gov.
- Walkerma (2005) Natriumsulfaatti [kuva] Haettu osoitteesta wikimedia.org.
- Wikipedia (2017) Kraft-prosessi. Haettu osoitteesta: wikipedia.org.
- Wikipedia (2017) Mirabilita. Haettu osoitteesta: wikipedia.org.
- Wikipedia (2017) Mirabilite. Haettu osoitteesta: wikipedia.org.
- Wikipedia (2017) Natriumsulfaatti. Haettu osoitteesta: wikipedia.org.
- Wikipedia (2017) Solfato di nátrium decaidrate. Haettu osoitteesta https://it.wikipedia.org.
- Wikipedia (2017) Natriumsulfaatti. Haettu osoitteesta: wikipedia.org.
- Wikipedia (2017) Thenardita. Haettu osoitteesta: wikipedia.org.
- Wikipedia (2017) Thenardite. Haettu osoitteesta: .wikipedia.org.


