Saponisaatioreaktio ja aineet, joita voidaan saada
saippuoiminen Se on esterin emäksinen hydrolyysi. Tämä tarkoittaa, että esteri reagoi emäksen (NaOH tai KOH) kanssa peruuttamattomasti, jolloin muodostuu alkoholia ja natriumin tai kaliumin karboksylaatteja. Sana tarkoittaa "saippuan valmistusta" ja on itse asiassa yksi ihmiskunnan käyttämistä vanhimmista kemiallisista reaktioista.
Babylonian aikoina puusta, kasveista ja eläinrasvoista kerättyjen tuhkojen avulla he täydensivät saippuan valmistuksen taidetta. Miksi eläinrasva? Syynä on se, että se sisältää runsaasti glyserolitriestereitä (triglyseridit), ja puun tuhka on kaliumin lähde..
Muussa tapauksessa reaktio etenee alhaisempaan saantoon, mutta riittää vastaamaan sen vaikutuksiin maaleihin ja joihinkin pintoihin. Näin on esimerkiksi öljymaalauksissa, joissa pigmentit sekoitetaan öljyn kanssa (estereiden lähde).
indeksi
- 1 Saponisaatioreaktio
- 1.1 Mekanismi
- 1.2 Kineettinen
- 2 Aineet, jotka voidaan saada saippuoimalla
- 2.1 Saippuoiden liuottimen vaikutus
- 3 Viitteet
Saponifikaatioreaktio
mekanismi
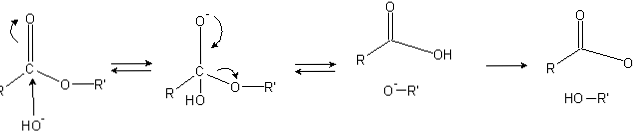
Estereissä on asyyliryhmä (O = C-R), joka on herkkä nukleofiilisille hyökkäyksille, kuten OH-.
Koska happiatomit "varastavat" elektronisen tiheyden hiiliatomista, se on osittain ladattu, vieläkin estereiden tapauksessa.
Näin ollen tämä positiivinen varaus houkuttelee negatiivisia lajeja, jotka kykenevät syöttämään elektroneja hiiliatomiin, jolloin nukleofiilinen hyökkäys tapahtuu (kuvan vasen puoli). Tämän seurauksena muodostuu tetraedrinen välituote (toinen molekyyli vasemmalta oikealle).
Tetraedrisen välituotteen hapen negatiivinen varaus on OH: n tuote- ympäröivä. Sitten tämä negatiivinen varaus siirretään uudelleen alkamaan karbonyyliryhmä, "pakottamalla" sitten hajottamaan C-OR'-sidos. Tämä siirtäminen tuottaa myös karboksyylihapon RCOOH: n ja alkoksidi-ionin R'O: n-.
Lopuksi, koska reaktioväliaine on emäksinen, alkoksidi deprotonoi yhden molekyylin vedestä ja karboksyylihappo reagoi toisen OH: n kanssa- muodostavat saippuoitumisen tuotteet.
kinetiikka
Saippuointireaktion nopeus on verrannollinen reagenssien konsentraatioihin. Toisin sanoen, lisäämällä joko esterin (RCOOR ') tai emäksen (NaOH) pitoisuutta, reaktio jatkuu suuremmalla nopeudella.
Tämä muunnetaan myös seuraavalla tavalla: saippuoitumisnopeus on ensim- mäinen järjestys suhteessa esteriin ja ensimmäinen järjestys alustan suhteen. Edellä mainitut voidaan ilmaista seuraavalla matemaattisella yhtälöllä:
Nopeus = k [RCOOR '] [NaOH]
Missä k on vakio tai nopeuskerroin, joka vaihtelee lämpötilan tai paineen funktiona; toisin sanoen mitä suurempi lämpö on, sitä suurempi on saippuoitumisnopeus. Tästä syystä väliaine kiehuu.
Koska molemmat reagenssit ovat ensimmäisen asteen kineettisiä, kokonaisreaktio on toinen järjestys.
Saippuoitumisen reaktiomekanismissa tetrahedraalisen välituotteen muodostuminen vaatii nukleofiilisen hyökkäyksen, johon liittyy sekä esteri että emäs..
Siten toisen asteen kinetiikka heijastuu tässä tosiasiassa, koska ne vaikuttavat reaktion (hidas) determinanttivaiheeseen.
Aineet, jotka voidaan saada saippuoimalla

Saippuoitumisen tärkeimmät tuotteet ovat alkoholit ja karboksyylihappojen suolat. Happoväliaineessa saadaan vastaava RCOOH, joka on saatu rasvojen ja öljyjen, jotka tunnetaan rasvahappoina, saippuoimalla..
Tällä tavoin saippuat koostuvat saippuoitumisesta johtuvien rasvahappojen suoloista. Menetkö ulos kationien kanssa? Ne voivat olla Na+, K+, mg2+, usko3+, etc.
Nämä suolat ovat liukoisia veteen, mutta saostuvat seokseen vaikuttavan NaCl: n vaikutuksesta, joka kuivaa saippuan ja erottaa sen vesifaasista. Saippuoitumisreaktio triglyseridille on seuraava:
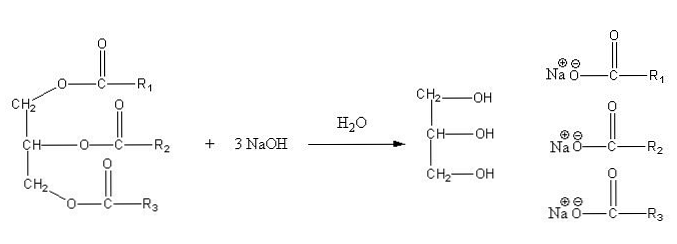
Glyseriini on alkoholipitoinen "E", ja saippua ovat kaikki saatujen rasvahappojen suolat. Tässä jokaisella sivuketjulla -R on eri pituudet ja tyydyttymättömyysaste. Näin ollen nämä ketjut eroavat rasvojen ja kasviöljyjen välillä.
Saippuan valmistuksen avain on siis parhaiden rasvojen ja öljyjen valinta tai tarkemmin sanottuna erilaisten triglyseridien lähteiden valinnassa..
Tämä valkoinen saippuamassa voi sisältää rakenteessaan väriaineita ja muita orgaanisia yhdisteitä, mikä antaa sille miellyttäviä aromeja ja kirkkaita värejä. Tältä osin mahdollisuuksien valikoima on koristeltu taiteen ja ammatin avulla tässä kaupassa.
Saippuointireaktio on kuitenkin myös karboksyylihappojen ja alkoholien synteettinen reitti, jotka eivät välttämättä koske glyseriiniä tai saippuoita.
Esimerkiksi minkä tahansa esterin emäksinen hydrolyysi, kuten yksinkertainen etyyliasetaatti, tuottaa etikkahappoa ja etanolia.
Saippuoiden liuottimen vaikutus

Rasvahappojen suolat ovat liukoisia veteen, mutta eivät samalla tavalla kuin ionit solvatoituvat; se on vesipallon ympäröimä. Saippuoiden tapauksessa niiden sivuketjut -R estävät niitä teoriassa liuottamasta veteen.
Siksi, jotta tämä energisesti epämiellyttävä asema voidaan torjua, ne suuntautuvat siten, että nämä ketjut joutuvat kosketuksiin muodostaen apolaarisen orgaanisen ytimen, kun taas polaariset päät, pää (-COO)- na+), vuorovaikutuksessa vesimolekyylien kanssa ja luoda "polaarinen kuori".
Yllä oleva kuva on esitetty yllä olevassa kuvassa, jossa on esitetty tällainen rakenne, joka tunnetaan nimellä micelle.
"Mustat hännät" vastaavat hydrofobisia ketjuja, jotka tarttuvat harmaiden pallojen suojaamaan orgaaniseen ytimeen. Nämä harmaat pallot muodostavat polaarisen suojan, päät -COO- na+.
Sitten mitsellit ovat rasvahappojen suolojen klustereita (klustereita). Näissä niissä voi olla rasvaa, joka on liukenematon veteen apolaarisen luonteensa vuoksi.
Miten he tekevät sen? Sekä rasva että -R-ketjut ovat hydrofobisia, joten molemmilla on suuri affiniteetti toisiaan kohtaan.
Kun micellit sisältävät rasvoja, vesi vuorovaikutuksessa polaarisen kuoren kanssa, mikä sallii saippuan liukoisuuden. Samoin mitselit latautuvat negatiivisesti, mikä aiheuttaa vastenmielisyyksiä toisiinsa ja siten tuottaa rasvan dispersiota.
viittaukset
- Anne Marie Helmenstine, Ph.D. (3. lokakuuta 2017). Saponisoinnin määritelmä ja reaktio. Haettu 24. huhtikuuta 2018 osoitteesta thinkco.com
- Francis A. Carey. Orgaaninen kemia Karboksyylihapot. (kuudes painos., s. 863-866). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Orgaaninen kemia. Lipidit (10. painos., Sivu 1056-1058). Wiley Plus.
- Wikipedia. (2018). Saippuoiminen. Haettu 24. huhtikuuta 2018 osoitteesta: en.wikipedia.org
- Boyd C. (27. helmikuuta 2015). Ymmärrä saippuan kemia ja historia. Haettu 24. huhtikuuta 2018 osoitteesta: chemservice.com
- Luca Laghi (27. maaliskuuta 2007). Saippuoiminen. Haettu 24. huhtikuuta 2018 osoitteesta: commons.wikimedia.org
- Amanda Virkkaa (12. toukokuuta 2015). Micelle (harmaasävy). Haettu 24. huhtikuuta 2018 osoitteesta: commons.wikimedia.org


