Natriumhydridin (NaH) ominaisuudet, reaktiivisuus, vaarat ja käyttötavat
natriumhydridi on epäorgaaninen yhdiste, jolla on kaava NaH. Sillä on ioninen sidos natriumin ja hydridin välillä. Sen rakenne on havainnollistettu kuviossa 1. Se edustaa suolaliuosta, mikä tarkoittaa, että se on suolaa vastaava hydridi, joka koostuu Na +: sta ja H-ioneista, toisin kuin enemmän molekyylihydridit, kuten boraani, metaani, ammoniakki ja vettä.
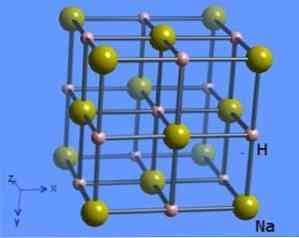
Kristallirakenteessa on koordinointinumero 6, jossa kutakin natriummolekyyliä ympäröi 8 hydridi-ionia, joilla on oktaedraalinen muoto ja jota on havainnollistettu kuviossa 2 (Mark Winter [Sheffieldin yliopisto ja WebElements Ltd, 1993-2016].
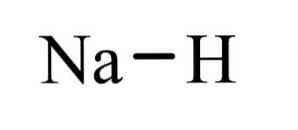
Yhdiste valmistetaan suoralla reaktiolla natrium- ja vetykaasun (natriumhydridikaava - natriumhydridikäyttö, ominaisuudet, rakenne ja kaava 2005-2017) välillä seuraavasti:
H2 + 2Na → 2NaH
Natriumhydridiä myydään kaupallisesti 60% w / w dispersiomuotona (paino-prosenttiosuus) mineraaliöljyssä turvallista käsittelyä varten (SODIUM HYDRIDE, s.f.).
indeksi
- 1 Natriumhydridin fysikaaliset ja kemialliset ominaisuudet
- 2 Reaktiivisuus ja vaarat
- 3 Käyttö
- 4 Viitteet
Natriumhydridin fysikaaliset ja kemialliset ominaisuudet
Natriumhydridi on valkoinen kiinteä aine, kun se on puhdasta, vaikka se yleensä saadaan harmaana tai hopeana. Sen ulkonäkö on esitetty kuvassa 3.

NaH: n molekyylipaino on 23,99771 g / mol, tiheys 1,396 g / ml ja sulamispiste 800 ° C (Royal Society of Chemistry, 2015). Se on liukenematon ammoniakkiin, bentseeniin, hiilitetrakloridiin ja hiilidisulfidiin (National Center for Biotechnology Information, s.f.).
Yhdiste on erittäin epävakaa. Puhdas NaH voi helposti syttyä ilmassa. Kun se joutuu kosketuksiin ilman kanssa, se vapauttaa erittäin helposti syttyvää vetyä.
Ilman ja kosteuden ollessa avoin NaH hydrolysoidaan helposti myös voimakkaaksi natriumhydroksidin (NaOH) syövyttäväksi alustaksi reaktion mukaan:
NaH + H20 → NaOH + H2
Tässä reaktiossa voidaan havaita, että natriumhydridi käyttäytyy emäksenä. Tämä johtuu elektronegatiivisuudesta.
Natriumilla on huomattavasti alhaisempi elektronegatiivisuus (≈1,0) kuin vety (.12,1), mikä tarkoittaa, että vety uuttaa elektronitiheyden itseään kohti siirtymällä natriumista natriumkationin ja anionin muodostamiseksi hydridi.
Jotta yhdiste olisi Brønsted-happo, sen täytyy erottaa elektronitiheys vetystä, toisin sanoen liittää se elektronegatiiviseen atomiin, kuten happeen, fluoriin, typpeen jne. Vasta sitten se voidaan muodollisesti kuvata H +: ksi, ja voidaanko se erottaa sinänsä.
Hydridi kuvataan paljon paremmin kuin H- ja siinä on vapaa elektronipari. Sellaisena se on Brønsted-emäs, ei happo. Itse asiassa, jos laajennat Brønsted-happo / emäsmääritystä Lewisin tekemällä tavalla, päädyt siihen johtopäätökseen, että natrium (Na +) on tässä happolaji.
H-emäksen ja H + -hapon Brønsted-happo- / emäsreaktiotuote muuttuu H2: ksi. Koska happohydrogeeni uutetaan suoraan vedestä, vetykaasu voi kuplia, syrjäyttäen tasapainon, vaikka reaktio ei ole termodynaamisesti edullinen.
OH-ioneja voidaan jättää, jotka voidaan kirjoittaa muulla Na + -kationilla, jolloin saadaan natriumhydroksidia (Miksi kiinteä natriumhydridipohjainen ei ole happo, kun se reagoi veden kanssa?, 2016).
Reaktiivisuus ja vaarat
Yhdiste on tehokas pelkistin. Hyökkää SiO2: lla lasissa. Se syttyy kosketuksissa kaasumaisen F2: n, Cl2: n, Br2: n ja I2: n kanssa (jälkimmäinen lämpötiloissa yli 100 ° C), erityisesti kosteuden läsnä ollessa, HF: n, HCl: n, HBr: n ja HI: n muodostamiseksi..
Reagoi rikin kanssa, jolloin saadaan Na2S ja H2S. Se voi reagoida räjähdysmäisesti dimetyylisulfoksidin kanssa. Reagoi voimakkaasti asetyleenin kanssa, jopa -60 ° C: ssa. Se on itsestään syttyvä fluorissa.
Se aloittaa polymerointireaktion etyyli-2,2,3-trifluoripropionaatissa, niin että esteri hajoaa voimakkaasti. Dietyylisukkinaatin ja etyylitrifluoriasetaatin läsnäolo reaktiossa on aiheuttanut räjähdyksiä (SODIUM HYDRIDE, 2016).
Natriumhydridiä pidetään syövyttävänä iholle tai silmille, koska vesipitoisten sivutuotteiden mahdolliset reaktiot veden kanssa ovat mahdollisia..
Silmiin joutuessaan ne on huuhdeltava suurella määrällä vettä, silmäluomien alle vähintään 15 minuuttia ja hakeuduttava välittömästi lääkärin hoitoon..
Jos iho joutuu iholle, harjaa välittömästi ja huuhtele ihoalue vedellä. Hakeudu lääkärin hoitoon, jos ärsytys jatkuu.
Se on haitallista nieltynä veden vaikutuksesta. Älä oksennuta. Hakeuduttava välittömästi lääkärin hoitoon ja siirrettävä uhri lääkärikeskukseen.
Natriumhydridin dispersio öljyssä ei ole pölyä. Kuitenkin materiaali, joka reagoi, voi lähettää hienoa syöväsumua. Hengitettynä huuhtele suu vedellä ja siirrä uhri paikkaan, jossa on raitista ilmaa. Lääkäriin on kiinnitettävä huomiota (Rhom and Hass Inc., 2007).
sovellukset
Natriumhydridin pääasiallinen käyttö on suorittaa kondensaatio- ja alkylointireaktioita, jotka kehittyvät karbanionin muodostumisen kautta (katalysoidaan emäksen avulla).
Öljyssä oleva natriumhydridi muistuttaa natrium- ja natriummetallialkoholaatteja sen kyvyssä toimia deprotonointiaineena asetoetikkaesterissä, Claisenissa, Stobbessa, Dieckmannissa ja muissa vastaavissa reaktioissa. Se on merkinnyt etuja muihin lauhdutusaineisiin verrattuna:
- Se on vahvempi emäs, joka johtaa suorempaan deprotonoitumiseen.
- Ylimäärä ei ole tarpeen.
- Tuotettu H2 antaa mitan reaktion laajuudesta.
- Toissijaiset reaktiot, kuten vähennykset, poistetaan.
Aromaattisten ja heterosyklisten amiinien, kuten 2-aminopyridiinin ja fenotiatsiinin, alkyloinnit saavutetaan helposti suurella saannolla käyttäen tolueeni- metyyliformamidin seoksia. Dimetyyliformamidin konsentraatio on muuttuja, jota käytetään reaktionopeuden säätämiseen (HINCKLEY, 1957).
On ehdotettu natriumhydridin käyttöä polttoainekennoyksiköissä käytettävän vedyn varastoimiseksi, jolloin hydridi suljetaan muovirakeisiin, jotka murskataan veden läsnä ollessa, jotta vety vapautuu.
viittaukset
- HINCKLEY, M. D. (1957). Natriumhydridin valmistus, käsittely ja käyttö. Advances in Chemistry, osa 19, 106 - 117.
- Mark Winter [Sheffieldin yliopisto ja WebElements Ltd, U. (1993-2016)]. Natrium: natriumhydridi. Haettu WebElementsistä: webelements.com.
- Kansallinen bioteknologian tiedotuskeskus. (N.D.). PubChem-yhdistelmätietokanta; CID = 24758. Haettu osoitteesta PubChem: pubchem.ncbi.nlm.nih.gov.
- Rhom ja Hass inc. (2007, joulukuu). Natriumhydridi 60% dispersio öljyssä. Haettu osoitteesta dow.com.
- Royal Society of Chemistry. (2015). Natriumhydridi. Haettu osoitteesta ChemSpider: chemspider.com.
- SODIUM HYDRIDE. (2016). Haettu osoitteesta cameochemicals: cameochemicals.noaa.gov.
- Natriumhydridikaava - natriumhydridin käyttö, ominaisuudet, rakenne ja kaava. (2005-2017). Haettu osoitteesta Softschools.com: softschools.com.
- SODIUM HYDRIDE. (N.D.). Haettu kemicallandista21: kemicalland21.com.
- Miksi kiinteä natriumhydridipohjainen ei ole happo, kun se reagoi veden kanssa? (2016, 20. huhtikuuta). Haettu osoitteesta stackexchange: chemistry.stackexchange.com.


