Magnesiumhydridikaava, kemiallinen rakenne ja ominaisuudet
magnesiumhydridi (MHG2 molekyylikaavalla) on kemiallinen yhdiste, jonka pitoisuus vetypitoisuudessa on 7,66% ja joka esiintyy luonnossa valkoisena kiteisenä kiinteänä aineena. Sitä käytetään pääasiassa muiden kemiallisten aineiden valmistukseen, vaikka sitä on tutkittu myös vedyn mahdollisena tallennusvälineenä.
Se kuuluu suolaliuoksen (tai ionisten) hydridien ryhmään, jotka on määritelty negatiivisesti varautuneella H-ionilla. Näitä hydridejä pidetään sellaisina, jotka on muodostettu alkalimetallien ja maa-alkalimetallien, mutta magnesiumin (ja berylliumin) tapauksessa on kovalenttisia sidoksia näiden ionien, jotka luonnehtivat tätä hydridiperhettä, lisäksi..
indeksi
- 1 Valmistus ja kaava
- 2 Kemiallinen rakenne
- 3 Fysikaaliset ja kemialliset ominaisuudet
- 3.1 Fyysinen
- 3.2 Kemikaalit
- 4 Käyttö
- 4.1 Vetyä varastointi
- 4.2 Hydrauksen ja dehydraation reaktiot
- 4.3 Muda
- 4.4 Polttokennot
- 4.5 Liikenne ja energia
- 4.6 Alkylointi
- 5 Riskit
- 5.1 Reaktio veden kanssa
- 5.2 Se on pyroforinen
- 6 Viitteet
Valmistelu ja kaava
Magnesiumhydridi muodostetaan suoralla hydrauksella magnesium- (Mg) -metallia korkeassa paineessa ja lämpötilassa (200 ilmakehää, 500 ° C) MgI-katalyytillä.2. Sen reaktio vastaa:
Mg + H2→ MgH2
MgH: n tuotanto on myös tutkittu2 alhaisissa lämpötiloissa käyttämällä pallomyllyissä tuotettua nanokiteistä magnesiumia.
On myös muita valmistusmenetelmiä, mutta ne edustavat monimutkaisempia kemiallisia reaktioita (magnesium-antraseenin hydraus, dietyylimagnesiumin reaktio litium-alumiinihydridin kanssa ja MgH-kompleksin tuote)2).
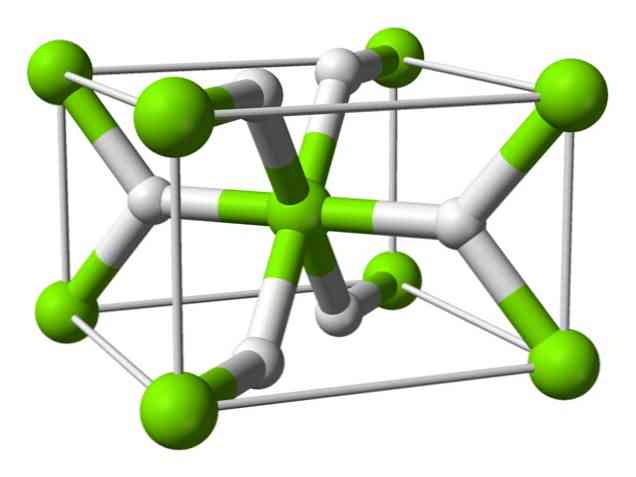
Kemiallinen rakenne
Tällä atomilla on rutiilin rakenne huoneenlämpötilassa, jossa on nelikulmainen kiteinen rakenne. Siinä on vähintään neljä erilaista muotoa korkeassa paineessa, ja myös stöhhiometrinen rakenne, jossa on vetypuutteita, on myös havaittu; jälkimmäinen esiintyy vain hyvin pieninä määrinä hiukkasia muodostuessaan.
Kuten edellä mainittiin, rutiilirakenteessa esiintyvillä sidoksilla on osittain kovalenttisia ominaisuuksia sen sijaan, että ne olisivat puhtaasti ionisia, kuten muutkin suolaliuokset..
Tämä saa magneettiatomin muodostamaan pallomaisen muodon, täysin ionisoituneen, mutta sen hydridi-ionilla on pitkänomainen rakenne.
Fysikaaliset ja kemialliset ominaisuudet
fyysinen
- Ulkonäkö: Valkoiset kiteet.
- Moolimassa: 26,3209 g / mol
- Tiheys: 1,45 g / cm3
- Sulamispiste: 285 ° C hajoaa
- Liukoisuus: Vedessä hajoaa.
Tämän kemiallisen yhdisteen molekyylipaino on 26 321 g / mol, tiheys 1,45 g / cm3 ja sen sulamispiste on 327 ° C.
kemiallinen
- Esiaste muiden kemiallisten aineiden valmistukseen.
- Vetyä varastointi, mahdollinen energialähde.
- Pelkistävä aine orgaanisessa synteesissä.
On tärkeää osoittaa, että tätä yhdistettä ei voida tuoda nestemäiseen tilaan, ja kun se kuljetetaan tai sen sulamispiste tai se johdetaan veteen, se hajoaa. Tämä hydridi on liukenematon eetteriin.
Se on erittäin reaktiivinen ja helposti syttyvä aine, ja se on myös pyroforinen, eli se voi syttyä itsestään ilmassa. Nämä kolme ehtoa edustavat turvallisuusriskejä, jotka mainitaan tämän artikkelin viimeisessä osassa.
sovellukset
Vetyä varastointi
Magnesiumhydridi reagoi helposti veden kanssa muodostaen vetykaasua seuraavan kemiallisen reaktion avulla:
MGH2+2H2O → 2H2+Mg (OH)2
Lisäksi tämä aine hajoaa 287 ° C: n lämpötilassa ja 1 bar: n paineessa seuraavasti:
MGH2→ Mg + H2
Siksi on ehdotettu magnesiumhydridin käyttöä vedyn varastointiväliaineena sen käyttöä ja kuljetusta varten.
Metallisen magnesiumin määrän hydrausta ja dehydrausta ehdotetaan keinoksi kuljettaa kaasumaisen vedyn määriä, jolloin varmistetaan, että sen kuljetuksessa ei ole vuotoa ja että se muodostaa turvallisemman ja käytännöllisemmän tavan kuin korkeapaineastioiden käytössä..
Hydraus- ja dehydrausreaktiot
Vaikka magnesiumhydridin hajoamislämpötila on sen käytön rajoittava tekijä, on ehdotettu menetelmiä hydraus- ja dehydrausreaktioiden kinetiikan parantamiseksi. Yksi näistä on magnesiumpartikkelin koon pienentäminen pallomyllyjen avulla.
muta
Lisäksi on ehdotettu järjestelmää, joka tuottaa magneettihydridiä mutan muodossa (hallittavampi ja turvallisempi kuin jauheessa tai muissa kiinteissä hiukkasissa), joka saatettaisiin reagoimaan veden kanssa halutun vedyn saamiseksi..
On arvioitu, että aikaisemmin nimetty liete muodostuisi hienoksi jauhetusta hydridistä, joka on suojattu öljyn suojakerroksella ja suspendoitu dispergoiviin aineisiin sen varmistamiseksi, että se säilyttää konsistenssinsa menettämättä materiaalia, ja että se ei absorboi kosteutta ympäristöstä..
Tällä lietteellä on se etu, että se voidaan pumpata minkä tahansa tavallisen dieselin, bensiinin tai vesipumpun kautta, mikä tekee tästä taloudellisesta ehdotuksesta sekä tehokkaasta.
Polttokennot
Magnesiumhydridiä voidaan toteuttaa kehittyneiden polttoainekennojen tuotannossa sekä paristojen ja energian varastoinnin luomisessa.
Kuljetus ja energia
Viime vuosikymmenten aikana on otettu huomioon vedyn käyttö energialähteenä. Vedyn istuttaminen polttoaineeksi edellyttää turvallisten ja kääntyvien varastointijärjestelmien löytämistä ja suuria tilavuuskapasiteetteja (vedyn määrä tilavuusyksikköä kohti) ja gravimetristä (vedyn määrä yksikkömäärää kohti)..
alkylointi
Alkylointi (lisätään CH-alkyyliryhmiä3R) orgaanisia yhdisteitä emäksisessä elatusaineessa, jossa on -OH-ryhmiä alhaisissa pitoisuuksissa ja lämpötiloissa, jotka ovat korkeampia kuin hydridin sulamispiste.
Tässä tapauksessa magnesiumhydridissä läsnä olevat vedyt (MgH2), liitä -OH-ryhmät, jotka muodostavat vettä. Vapaa magnesium voi saada halogeenin, joka usein liittyy alkyylimolekyyliin, joka on tarkoitettu sitoutumaan hiilivetyketjuun.
riskejä
Reaktio veden kanssa
Kuten jo mainittiin, magnesiumhydridi on aine, joka reagoi hyvin helposti ja väkivaltaisesti vedellä ja joka kykenee räjähtämään suuremmilla pitoisuuksilla.
Tämä johtuu siitä, että sen eksoterminen reaktio tuottaa tarpeeksi lämpöä hajottamisreaktiossa vapautuneen vetykaasun sytyttämiseksi, mikä johtaa melko vaaralliseen ketjureaktioon..
Se on pyroforinen
Magnesiumhydridi on myös pyroforinen, mikä tarkoittaa, että se voi syttyä itsestään kostean ilman läsnä ollessa ja muodostaa magnesiumoksidia ja vettä.
Sen hengittämistä ei suositella kiinteässä tilassa tai kosketuksissa sen höyryjen kanssa: aine luonnollisessa tilassa ja hajoamistuotteet voivat aiheuttaa vakavia vammoja tai jopa kuoleman.
Se voi aiheuttaa syövyttäviä liuoksia, jotka ovat kosketuksissa veden kanssa ja saastuttavat sitä. Kosketus ihon ja silmien kanssa ei ole suositeltavaa ja aiheuttaa myös ärsytystä limakalvoissa.
Ei ole osoitettu, että magnesiumhydridi voi tuottaa kroonisia terveysvaikutuksia, kuten syöpää, lisääntymisvaurioita tai muita fyysisiä tai psyykkisiä seurauksia, mutta suojavarusteiden käyttö on suositeltavaa sen käsittelyssä (erityisesti hengityssuojaimet tai naamarit sen hienoa pölyä).
Kun työskentelet tämän aineen kanssa, ilman kosteus on pidettävä alhaisella tasolla, sammuttava kaikki sytytyslähteet ja kuljetettava ne rumpuihin tai muihin säiliöihin..
Sinun tulee aina välttää suuria pitoisuuksia tämän aineen kanssa, kun sitä voidaan välttää, koska räjähdysmahdollisuus vähenee merkittävästi.
Jos tapahtuu magnesiumhydridin vuoto, työalue on eristettävä ja pöly kerättävä pölynimurilla. Älä koskaan käytä kuivapuhdistusmenetelmää; lisää mahdollisuutta reaktioon hydridin kanssa.
viittaukset
- Zumdahl, S. S. (1998). Encyclopedia Britannica. Otettu britannica.comista.
- Pubchem. (2005). PubChem Open Chemistry -tietokanta. Otettu pubchem.ncbi.nlm.nih.gov.
- Safe Hydrogen, L. (2006). Green Car Congress. Otettu osoitteesta greencarcongress.com.
- Kemikaalit, C. (n.d.). Cameo Chemicals. Otettu cameochemicals.noaa.gov.
- Services, N. J. (1987). New Jerseyn terveys- ja vanhempien palveluiden laitos. Otettu nj.govista.


