Etaanirakenne, ominaisuudet, käyttötavat ja riskit
etaani on yksinkertainen hiilivety, jolla on kaava C2H6 väritön ja hajuton kaasu, jolla on erittäin arvokas ja monipuolinen käyttö eteenin synteesissä. Lisäksi se on yksi maanpäällisistä kaasuista, joita on havaittu myös muissa planeetoissa ja tähtikappaleissa aurinkokunnan ympärillä. Tutkija Michael Faraday löysi sen vuonna 1834.
Hiili- ja vetyatomien muodostamien suurten orgaanisten yhdisteiden (tunnetaan hiilivedyinä) joukossa on niitä, jotka ovat kaasumaisessa tilassa lämpötiloissa ja ympäristöpaineissa, joita käytetään valtavasti monilla toimialoilla.
Nämä ovat tavallisesti kaasumaisesta seoksesta, jota kutsutaan "maakaasuksi", joka on ihmiskunnalle erittäin arvokas tuote ja joka koostuu mm. Metaanityypistä metaania, etaania, propaania ja butaania; luokitellaan sen ketjun hiiliatomien määrän mukaan.
indeksi
- 1 Kemiallinen rakenne
- 1.1 Etaanin synteesi
- 2 Ominaisuudet
- 2.1 Etaanin liukoisuus
- 2.2 Etaanin kiteytys
- 2.3 Etaanin polttaminen
- 2.4 Eteeni ilmakehässä ja taivaankappaleissa
- 3 Käyttö
- 3.1 Eteenin tuotanto
- 3.2 Peruskemikaalien koulutus
- 3.3 Kylmäaine
- 4 Etaaniriskit
- 5 Viitteet
Kemiallinen rakenne
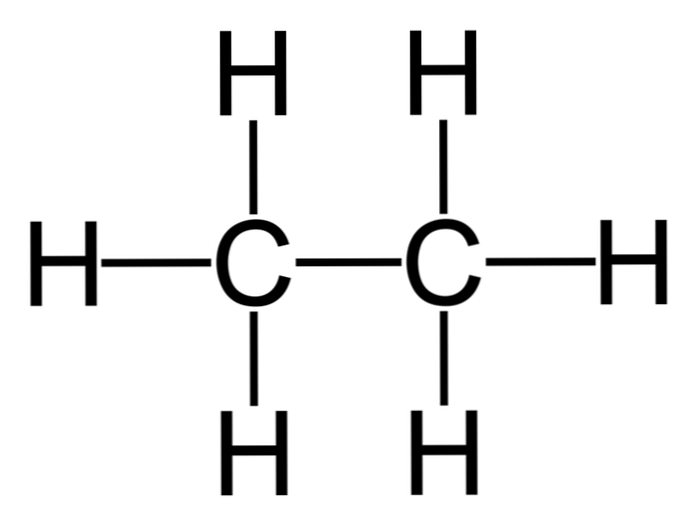
Etaani on molekyyli, jolla on kaava C2H6, nähdään tyypillisesti kahden metyyliryhmän (-CH3) muodostaa yksinkertaisen hiilen ja hiilen sidoksen hiilivety. Se on myös yksinkertaisin orgaaninen yhdiste metaanin jälkeen.
H3C-CH3
Tämän molekyylin hiiliatomeilla on sp-hybridisaatio3, joten molekyylisidokset ovat vapaan kiertoon.
Lisäksi on olemassa etaanin sisäinen ilmiö, joka perustuu samankaltaisen molekyylirakenteen kiertoon ja vähimmäisenergiaan, joka tarvitaan 360 asteen sidoksen pyörimiseksi, jota tutkijat ovat kutsuneet "etaanisuluksi".
Tästä syystä etaani voi esiintyä eri kokoonpanoissa sen pyörimisen mukaan, vaikka sen stabiilimpi konformaatio on olemassa silloin, kun vedyt ovat toisiaan vastapäätä (kuten kuvassa esitetään)..

Etaanin synteesi
Etaani voidaan helposti syntetisoida Kolben elektrolyysistä, orgaanisesta reaktiosta, jossa tapahtuu kaksi vaihetta: kahden karboksyylihapon sähkökemiallinen dekarboksylointi (karboksyyliryhmän poistaminen ja hiilidioksidin vapautuminen) ja tuotteiden yhdistelmä. välituotteita kovalenttisen sidoksen muodostamiseksi.
Samoin etikkahapon elektrolyysi johtaa etaanin ja hiilidioksidin muodostumiseen, ja tätä reaktiota käytetään ensimmäisen synteesiin.
Hapetus etikkahappoanhydridiä vaikutuksesta peroksidit, yksi samanlainen Kolbe elektrolyysin käsite myös johtaa siihen, että muodostuu etaanin.
Samalla tavalla se voidaan erottaa tehokkaasti maakaasusta ja metaanista nesteytysprosessilla käyttämällä kryogeenisiä järjestelmiä tämän kaasun sieppaamiseksi ja erottamiseksi seoksista muiden kaasujen kanssa..
Turbo-laajennusprosessi on edullinen tähän rooliin: kaasuseos johdetaan turbiinin läpi, jolloin muodostuu sen laajeneminen, kunnes sen lämpötila laskee alle -100ºC.
Jo tässä vaiheessa seoksen komponentit voidaan erottaa toisistaan, niin että nestemäinen etaani erotetaan kaasumaisesta metaanista ja muista lajeista, jotka liittyvät tislauksen käyttöön..
ominaisuudet
Etaani esiintyy luonnossa hajuttomana ja värittömänä kaasuna vakiopaineissa ja lämpötiloissa (1 atm ja 25 ° C). Sen kiehumispiste on -88,5 ° C ja sulamispiste -182,8 ° C. Lisäksi voimakkaiden happojen tai emästen altistuminen ei vaikuta siihen.
Etanoliliukoisuus
Etaanimolekyylit ovat symmetrisiä ja niillä on heikkoja vetovoimia, jotka pitävät ne yhdessä, nimeltään dispersiovoimat.
Kun etaania yritetään liuottaa veteen, kaasun ja nesteen väliset vetovoimat ovat hyvin heikkoja, joten etaanin liittäminen vesimolekyyleihin on hyvin vaikeaa.
Tästä syystä etaanin liukoisuus on huomattavasti alhainen, kun se kasvaa hieman järjestelmän paineen noustessa.
Etaanin kiteytys
Etaani voidaan kiinteytyä, mikä johtaa epävakaiden etaanikiteiden muodostumiseen, jossa on kuutiomainen kiteinen rakenne.
Kun lämpötila laskee yli -183,2 ° C, tämä rakenne muuttuu monokliiniseksi, mikä lisää sen molekyylin stabiilisuutta.
Etaanipoltto
Tämä hiilivety, vaikka se ei ole laajalti käytetään polttoaineena, voidaan käyttää poltto- prosesseissa tuottaa hiilidioksidia ja kuuma vesi, joka on edustettuina:
2C2H6 + 7o2 → 4CO2 + 6H2O + 3120 kJ
On myös mahdollisuus polttaa tämä molekyyli ilman ylimääräistä happea, joka tunnetaan nimellä "epätäydellinen palaminen" ja joka johtaa amorfisen hiilen ja hiilimonoksidin muodostumiseen ei-toivotussa reaktiossa riippuen käytetyn hapen määrästä. :
2C2H6 + 3O2 → 4C + 6H2O + Lämpö
2C2H6 + 4O2 → 2C + 2CO + 6H2O + Lämpö
2C2H6 + 5O2 → 4CO + 6H2O + Lämpö
Tällä alueella palaminen tapahtuu sarjaan vapaita radikaaleja, jotka on numeroitu satojen eri reaktioiden joukossa. Esimerkiksi yhdisteitä, kuten formaldehydiä, asetaldehydiä, metaania, metanolia ja etanolia, voidaan muodostaa epätäydellisissä palamisreaktioissa..
Tämä riippuu olosuhteista, joissa reaktio tapahtuu, ja vapaiden radikaalien reaktioista. Etyleeni voidaan muodostaa myös korkeissa lämpötiloissa (600-900 ºC), joka on teollisuus erittäin haluttu tuote.
Etaani ilmakehässä ja taivaankappaleet
Etaani esiintyy maapallon ilmapiirissä jälkiä, ja epäillään, että ihminen on onnistunut kaksinkertaistamaan tämän keskittymisen, koska hän alkoi harjoittaa teollista toimintaa.
Tutkijat ajattelevat, että suuri osa nykyisestä etaanin läsnäolosta ilmakehässä johtuu fossiilisten polttoaineiden poltosta, vaikka etaanin maailmanlaajuinen päästö on vähentynyt lähes puolet, kun liuskekaasun tuotantoteknologiaa parannettiin (a maakaasun lähde).
Tätä lajia tuottaa luonnollisesti myös aurinkosäteilyn vaikutus ilmakehän metaaniin, joka yhdistää ja muodostaa etaanimolekyylin..
Etaani on nestemäisessä tilassa Titanin, yhden Saturnuksen kuun pinnalla. Tämä tapahtuu suuremmalla määrällä Vid Flumina -joella, joka virtaa yli 400 kilometriä yhdestä merestä. Tätä yhdistettä on myös todistettu komeetoilla ja Pluton pinnalla.
sovellukset
Eteenin tuotanto
Käyttöä etaanin perustuu ensisijaisesti eteenin, orgaaninen tuote käytetään laajasti maailman tuotannosta, kautta prosessia kutsutaan halkeilua höyryfaasissa.
Tämä menetelmä käsittää etaanin syöttämisen höyryllä laimennettuna uuniin, lämmittämällä sitä nopeasti ilman happea.
Reaktio tapahtuu äärimmäisen korkeassa lämpötilassa (välillä 850 - 900 ºC), mutta viipymisaika (etaanin kulunut aika uunissa) on oltava lyhyt, jotta reaktio olisi tehokas. Korkeammissa lämpötiloissa syntyy enemmän eteeniä.
Peruskemikaalien koulutus
Etaania on tutkittu myös tärkeimpänä komponenttina peruskemikaalien muodostamisessa. Oksidatiivinen klooraus on yksi prosesseista, joita ehdotetaan vinyylikloridin (PVC-komponentin) saamiseksi, korvaamalla halvemmat ja monimutkaisemmat.
jäähdytysaine
Lopuksi etaania käytetään kylmäaineena tavallisissa kryogeenisissä järjestelmissä, mikä osoittaa myös kyvyn jäädyttää pieniä näytteitä laboratoriossa analysointia varten..
Se on erittäin hyvä korvike vedelle, joka kestää herkempien näytteiden jäähdyttämisen kauemmin ja voi myös aiheuttaa haitallisten jääkiteiden muodostumista.
Etaaniriskit
-Etaanilla on kyky syttyä, varsinkin kun se sitoutuu ilmaan. Ilmassa olevan etaanin tilavuusprosentteina 3,0 - 12,5% voi muodostua räjähtävä seos.
-Se voi rajoittaa sen ilman happea, jossa se löytyy, ja tästä syystä se aiheuttaa läsnäolevien ja altistuneiden ihmisten ja eläinten tukehtumisriskin..
-Nestemäinen etaani jäädytetty voi vakavasti polttaa ihoa, jos kosketus on tehty sen kanssa, ja toimivat myös cryomedium ratkaisuja kohde se koskettaa, jäätyminen hetkessä.
-Neste etaani höyryt ovat ilmaa raskaampia ja ovat keskittyneet maassa, tämä voi aiheuttaa syttymisvaaraa, joka voi tuottaa polttomoottorin reaktio ketju.
-Etaanin nauttiminen voi aiheuttaa pahoinvointia, oksentelua ja sisäistä verenvuotoa. Hengitys aiheuttaa tukehtumisen lisäksi päänsärkyä, sekavuutta ja mielialan vaihteluja. Kuolema sydänpysähdyksestä on mahdollista suurilla altistuksilla.
-Se edustaa kasvihuonekaasua, joka yhdessä metaanin ja hiilidioksidin kanssa edistää ilmaston lämpenemistä ja ihmisten saastumisen aiheuttamaa ilmastonmuutosta. Onneksi se on vähemmän runsas ja kestävä kuin metaani, ja se imee vähemmän säteilyä kuin tämä.
viittaukset
- Britannica, E. (s.f.). Etaani. Haettu osoitteesta britannica.com
- Nes, G. V. (s.f.). Etaanin, eteenin ja asetyleenin yksikristalli- ja elektronitiheysjakaumat. Palautettu rug.nl: stä
- Sivustot, G. (s.f.). Etaani: Lähteet ja nielut. Haettu osoitteesta sites.google.com
- SoftSchools. (N.D.). Etaanikaava. Palautettu softschools.comista
- Wikipedia. (N.D.). Etaani. Haettu osoitteesta en.wikipedia.org


