Vahvat ja heikot elektrolyytit, erot, esimerkit
elektrolyyttejä ne ovat aineita, jotka tuottavat sähköä johtavan liuoksen, kun se on liuotettu polaariseen liuottimeen, kuten veteen. Liuotettu elektrolyytti erotetaan kationeiksi ja anioneiksi, jotka dispergoidaan mainittuun liuokseen. Jos ratkaisuun kohdistetaan sähköpotentiaali, kationit kiinnittyvät elektrodiin, jolla on runsaasti elektroneja.
Sitä vastoin liuoksessa olevat anionit sitoutuvat sähköisesti puutteelliseen elektrodiin. Aineeksi, joka hajoaa ioneiksi, saadaan kyky johtaa sähköä. Useimmat suolat, hapot ja liukoiset emäkset edustavat elektrolyyttejä.
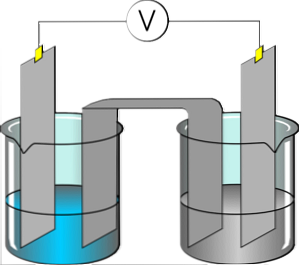
Jotkut kaasut, kuten kloorivety, voivat toimia elektrolyytteinä tietyissä lämpötila- ja paineolosuhteissa. Natrium, kalium, kloridi, kalsium, magnesium ja fosfaatti ovat hyviä esimerkkejä elektrolyytteistä.
indeksi
- 1 Mitkä ovat vahvat ja heikot elektrolyytit?
- 2 Eroja
- 3 Menetelmät elektrolyyttien tunnistamiseksi
- 4 Esimerkkejä vahvoista ja heikoista elektrolyytteistä
- 4.1 Vahvat elektrolyytit
- 4.2 Heikko elektrolyytti
- 5 Viitteet
Mitkä ovat vahvat ja heikot elektrolyytit?
vahvat elektrolyytit ovat ne, jotka täysin ionisoivat - eli ne on 100% erotettu toisistaan heikko elektrolyytti ne ionisoituvat vain osittain. Tämä ionisaatioprosentti on yleensä noin 1 - 10%.
Näiden kahden elektrolyyttityypin erottamiseksi paremmin voidaan todeta, että vahvan elektrolyytin liuoksessa tärkeimmät lajit (tai lajit) ovat tuloksena olevia ioneja, kun taas heikossa elektrolyyttiliuoksessa päälaji on itse yhdiste. ionize.
Vahvat elektrolyytit jaetaan kolmeen luokkaan: vahvat hapot, vahvat emäkset ja suolat; kun taas heikot elektrolyytit on jaettu heikkoihin happoihin ja heikkoihin emäksiin.
Kaikki ioniset yhdisteet ovat vahvoja elektrolyyttejä, koska ne erottuvat ioneiksi, kun ne liukenevat veteen.
Jopa kaikkein liukenemattomat ioniset yhdisteet (AgCl, PbSO4, CaCO3) ovat vahvoja elektrolyyttejä, koska pienet määrät, jotka liukenevat veteen, tekevät sen pääasiassa ionien muodossa; toisin sanoen ei ole hajotettua muotoa tai yhdisteen määrää tuloksena olevassa liuoksessa.
Elektrolyyttien vastaava johtavuus pienenee korkeammissa lämpötiloissa, mutta käyttäytyy eri tavoin niiden lujuuden mukaan.
Vahvilla elektrolyytteillä on pienempi johtokyvyn lasku suuremmilla pitoisuuksilla, kun taas heikoilla elektrolyytteillä on suuri johtokyvyn lasku suuremmilla pitoisuuksilla.
erot
On tärkeää tietää, miten tunnistaa kaava ja tunnistaa, missä luokituksessa se on (ioni tai yhdiste), koska tämä riippuu turvallisuusstandardeista kemikaaleja käytettäessä.
Kuten edellä todettiin, elektrolyytit voidaan tunnistaa voimakkaiksi tai heikkoiksi niiden ionisaatiokapasiteetin mukaan, mutta tämä voi joskus olla selvempi kuin näyttää.
Useimpia happoja, emäksiä ja liukoisia suoloja, jotka eivät ole happoja tai heikkoja emäksiä, pidetään heikkoina elektrolyytteinä.
Itse asiassa on oletettava, että kaikki suolat ovat vahvoja elektrolyyttejä. Sen sijaan heikkoja happoja ja emäksiä pidetään typpipitoisten yhdisteiden lisäksi heikkoina elektrolyytteinä.
Menetelmät elektrolyyttien tunnistamiseksi
On olemassa menetelmiä elektrolyyttien tunnistamisen helpottamiseksi. Seuraavaksi käytetään kuuden vaiheen menetelmää:
- Onko elektrolyytti yksi seitsemästä vahvasta haposta?
- Onko se metallimuodossa (OH)n? Sitten se on vahva perusta.
- Onko se metallimuodossa (X)n? Sitten se on suola.
- Aloitetaanko kaava H: lla? Sitten se on luultavasti heikko happo.
- Onko sillä typpiatomi? Sitten se voi olla heikko pohja.
- Mitään edellä mainituista ei sovelleta? Sitten se ei ole elektrolyytti.
Lisäksi, jos elektrolyytin esittämä reaktio näyttää seuraavalta: NaCl (s) → Na+(ac) + Cl-(ac), jossa reaktio rajataan suoralla reaktiolla (→), puhumme vahvasta elektrolyytistä. Jos se on rajattu epäsuoraan ((), se on heikko elektrolyytti.
Kuten edellisessä kappaleessa todettiin, elektrolyytin johtavuus vaihtelee tämän liuoksen konsentraation mukaan, mutta myös tämä arvo riippuu elektrolyytin lujuudesta.
Korkeammilla pitoisuuksilla voimakkaat ja välitön elektrolyytit eivät vähene merkittävästi, mutta heikot aiheuttavat suuren laskun, kunnes arvot ovat lähellä nollaa suuremmilla pitoisuuksilla..
On myös välitöntä elektrolyyttiä, jotka voidaan hajottaa liuoksissa suurempina prosentteina (alle 100%, mutta yli 10%) ei-elektrolyyttien lisäksi, jotka yksinkertaisesti eivät hajoa (hiiliyhdisteet, kuten sokerit, rasvat ja alkoholit).

Esimerkkejä vahvoista ja heikoista elektrolyytteistä
Vahvat elektrolyytit
Vahvat hapot:
- Perklorihappo (HClO4)
- Vesivetyhappo (HBr)
- Kloorivetyhappo (HCl)
- Rikkihappo (H2SW4)
- Typpihappo (HNO)3)
- Periodinen happo (HIO)4)
- Fluoroantimonihappo (HSbF)6)
- Maaginen happo (SbF)5)
- Fluorisulfonihappo (FSO)3H)
Vahvat emäkset
- Litiumhydroksidi (LiOH)
- Natriumhydroksidi (NaOH)
- Kaliumhydroksidi (KOH)
- Rubidiumhydroksidi (RbOH)
- Cesiumhydroksidi (CsOH)
- Kalsiumhydroksidi (Ca (OH))2)
- Strontiumhydroksidi (Sr (OH)2)
- Bariumhydroksidi (Ba (OH)2)
- Natriumamidi (NaNH)2)
Vahva myynti
- Natriumkloridi (NaCl)
- Kaliumnitraatti (KNO)3)
- Magnesiumkloridi (MgCl2)
- Natriumasetaatti (CH3COONa)
Heikko elektrolyytit
Heikko hapot
- Etikkahappo (CH3COOH)
- Bentsoehappo (C6H5COOH)
- Muurahaishappo (HCOOH)
- Vety syanidi (HCN)
- Kloorietikkahappo (CH2ClOOH)
- Jodihappo (HIO)3)
- Typpihappo (HNO)2)
- Hiilihappo (H2CO3)
- Fosforihappo (H3PO4)
- Rikkihappo (H2SW3)
Heikko emäkset ja typpiyhdisteet
- Dimetyyliamiini ((CH3)2NH)
- Etyyliamiini (C2H5NH2)
- Ammoniakki (NH3)
- Hydroksyyliamiini (NH2OH)
- Pyridiini (C5H5N)
- Aniliini (C6H5NH2)
viittaukset
- Vahva elektrolyytti. Haettu osoitteesta en.wikipedia.org
- Anne Helmenstine, P. (s.f.). Tiede toteaa Haettu osoitteesta sciencenotes.org
- OpenCourseWare. (N.D.). UMass Boston. Haettu osoitteesta ocw.umb.edu
- Kemia, D. o. (N.D.). St. Olaf College. Haettu osoitteesta stolaf.edu
- Anne Marie Helmenstine, P. (s.f.). ThoughtCo. Haettu osoitteesta thinkco.com


