Veden elektrolyysimenetelmä, tekniikat, mikä se on, kotikokeilu
veden elektrolyysi se on veden hajoaminen sen perusosiksi, kun käytetään sähkövirtaa. Menettelyn aikana muodostuu vety ja molekyyli happi kahdelle inertille pinnalle, H2 ja O2. Nämä kaksi pintaa tunnetaan paremmin elektrodien nimillä.
Teoreettisesti H: n tilavuus2 muodostetun määrän on oltava kaksi kertaa tilavuus O2. Miksi? Koska vesimolekyylin H / O-suhde on 2, eli kaksi H kutakin happea kohden. Tämä suhde tarkistetaan suoraan sen kemiallisella kaavalla, H2O. Kuitenkin monet kokeelliset tekijät vaikuttavat saatuihin tilavuuteen.

Jos elektrolyysi suoritetaan veteen upotettujen putkien sisällä (yläkuva), alemman korkeuden vesipylväs vastaa vetyä, koska nesteen pinnalle kohdistuu suurempaa määrää kaasua. Kuplat ympäröivät elektrodeja ja nousevat sen jälkeen, kun veden höyrynpaine vanhenee.
Huomaa, että putket on erotettu toisistaan siten, että kaasuja kulkeutuu vähän elektrodista toiseen. Pienillä asteikoilla tämä ei aiheuta välitöntä riskiä; mutta teollisuusvaaka, H: n kaasuseos2 ja O2 Se on erittäin vaarallista ja räjähtävää.
Tästä syystä sähkökemialliset solut, joissa suoritetaan veden elektrolyysi, ovat erittäin kalliita; ne tarvitsevat suunnittelun ja elementit, jotka takaavat, että kaasut eivät koskaan sekoita, kannattava virtalähde, suuret elektrolyyttipitoisuudet, erityiset elektrodit (elektrokatalyytit) ja mekanismit H: n säilyttämiseksi.2 valmistettu.
Elektrokatalyytit edustavat kitkaa ja samanaikaisesti veden elektrolyysin kannattavuutta. Jotkut koostuvat jalometallien oksideista, kuten platinasta ja iridiumista, joiden hinnat ovat erittäin korkeat. Juuri tässä vaiheessa tutkijat yhdistävät voimansa tehokkaiden, vakaiden ja halpojen elektrodien suunnitteluun.
Syynä näihin pyrkimyksiin on nopeuttaa O: n muodostumista2, joka annetaan pienemmillä nopeuksilla H: hen verrattuna2. Tämä hidastuu elektrodilla, jossa O on muodostettu2 yleisenä seurauksena on paljon suurempaa potentiaalia käyttävän potentiaalin soveltaminen (yliarviointi); mikä on sama, alentaa suorituskykyä ja suurempia kustannuksia.
indeksi
- 1 Elektrolyysin reaktio
- 1.1 Puolisolujen reaktiot
- 2 Menettely
- 3 Tekniikat
- 3.1 Elektrolyysi emäksisellä vedellä
- 3.2 Elektrolyysi polymeerielektrolyyttikalvolla
- 3.3 Elektrolyysi kiinteillä oksideilla
- 4 Mikä on vesielektrolyysin käyttö??
- 4.1 Vetyä ja sen käyttöä
- 4.2 Vianmääritysmenetelmänä
- 4.3 Hapen syöttö
- 5 Kotikokeilu
- 5.1 Kotimuuttujat
- 6 Viitteet
Elektrolyysireaktio
Veden elektrolyysi käsittää monia monimutkaisia näkökohtia. Yleisesti ottaen sen perustana on yksinkertainen maailmanlaajuinen reaktio:
2H2O (l) => 2H2(g) + O2(G)
Kuten yhtälössä todetaan, kaksi vesimolekyyliä puuttuu: yksi on yleensä vähennettävä tai saada elektroneja, kun taas toinen on hapettava tai menettää elektroneja.
H2 Se on veden vähentämisen tuote, koska elektronien vahvistus edistää protoneja H+ voidaan sitoa kovalenttisesti ja happi muuntaa OH: ksi-. Siksi H2 tapahtuu katodissa, joka on elektrodi, jossa pelkistys tapahtuu.
Vaikka O2 tulee veden hapetuksesta, koska se menettää elektronit, jotka sallivat sen sitoutua vetyyn, ja vapauttaa siten protoneja H+. O2 esiintyy anodissa, elektrodissa, jossa tapahtuu hapettumista; ja toisin kuin toinen elektrodi, anodin ympärillä oleva pH on hapan eikä emäksinen.
Puolisolujen reaktiot
Edellä mainitut voidaan tiivistää seuraavilla kemiallisilla yhtälöillä puolisolujen reaktioiden osalta:
2H2O + 2e- => H2 + 2OH- (Katodi, perus)
2H2O => O2 + 4H+ + 4e- (Anodi, happo)
Vesi ei kuitenkaan voi menettää enemmän elektroneja (4e-) joista toinen vesimolekyyli voittaa katodilla (2e-); näin ollen ensimmäinen yhtälö on kerrottava 2: lla ja vähennettävä sitten toisella yhtälöllä nettoyhtälön saamiseksi:
2 (2H2O + 2e- => H2 + 2OH-)
2H2O => O2 + 4H+ + 4e-
6H2O => 2H2 + O2 + 4H+ + 4OH-
Mutta 4H+ ja 4OH- ne muodostavat 4H: n2Tai siten nämä eliminoivat neljä kuudesta H-molekyylistä2Tai jättää kaksi; ja tulos on juuri syntynyt maailmanlaajuinen reaktio.
Puolisolu-reaktiot muuttuvat pH-arvojen, tekniikoiden ja myös potentiaalisten pelkistys- tai hapetuspotentiaalien kanssa, jotka määräävät, kuinka paljon virtaa on toimitettava, jotta veden elektrolyysi etenee spontaanisti.
prosessi
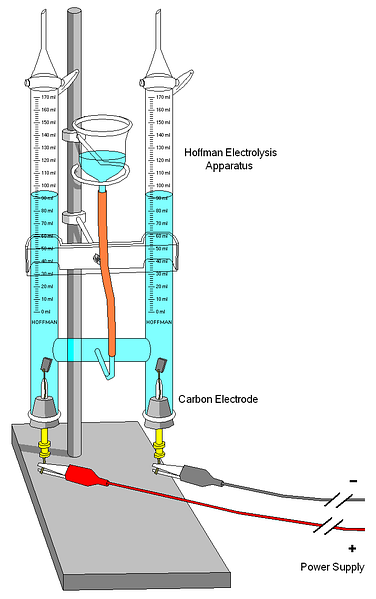
Ylemmässä kuvassa näkyy Hoffmanin volttimittari. Sylinterit täytetään vedellä ja valitut elektrolyytit keskisuuttimen läpi. Näiden elektrolyyttien tehtävänä on lisätä veden johtavuutta, koska normaaleissa olosuhteissa H-ioneja on hyvin vähän3O+ ja OH- automaattisen ionisaation tuotteet.
Nämä kaksi elektrodia ovat tavallisesti platinaa, vaikka kuvassa ne korvattiin hiilielektrodeilla. Molemmat on kytketty akkuun, jolla käytetään veden erottumista edistävää potentiaalivaihtoa (ΔV) (O-muodostus).2).
Elektronit kulkevat koko piirissä, kunnes saavutat toisen elektrodin, jossa vesi voittaa ja tulee H: ksi2 ja OH-. Tässä vaiheessa anodi ja katodi ovat jo määriteltyjä, jotka voidaan erottaa vesipylväiden korkeuden mukaan; pienempi korkeus vastaa katodia, jossa H muodostuu2.
Sylinterien yläosassa on joitakin avaimia, jotka mahdollistavat syntyvien kaasujen vapauttamisen. Voit tarkistaa huolellisesti H: n läsnäolon2 se reagoi liekin kanssa, jonka palaminen tuottaa kaasumaista vettä.
tekniikat
Veden elektrolyysitekniikat vaihtelevat riippuen H: n määrästä2 ja O2 jota ehdotetaan tuottavan. Molemmat kaasut ovat erittäin vaarallisia, jos ne sekoitetaan keskenään, ja siksi elektrolyyttisoluissa on monimutkaisia malleja, joilla minimoidaan kaasupaineiden nousu ja niiden diffuusio vesipitoisen väliaineen läpi..
Myös tekniikat värähtelevät riippuen solusta, veteen lisätystä elektrolyytistä ja itse elektrodeista. Toisaalta jotkut viittaavat siihen, että reaktio toteutetaan korkeammissa lämpötiloissa, vähentämällä sähkön kulutusta, ja toiset käyttävät valtavia paineita H: n ylläpitämiseksi.2 tallennettu.
Kaikista tekniikoista voidaan mainita seuraavat kolme:
Elektrolyysi alkalisella vedellä
Elektrolyysi suoritetaan alkalimetallien (KOH tai NaOH) emäksisillä liuoksilla. Tällä tekniikalla esiintyy reaktioita:
4H2O (l) + 4e- => 2H2(g) + 4OH-(Aq)
4OH-(ac) => O2(g) + 2H2O (l) + 4e-
Kuten voidaan nähdä, sekä katodissa että anodissa, vedessä on emäksinen pH; ja lisäksi OH- siirtyä anodiin, jossa ne hapettuvat O: ksi2.
Elektrolyysi polymeerielektrolyyttisellä kalvolla
Tässä tekniikassa käytetään kiinteää polymeeriä, joka toimii läpäisevänä kalvona H: lle+, mutta vedenpitävä kaasuille. Tämä takaa suuremman turvallisuuden elektrolyysin aikana.
Puolisolu-reaktiot tässä tapauksessa ovat:
4H+(ac) + 4e- => 2H2(G)
2H2O (l) => O2(g) + 4H+(ac) + 4e-
H-ionit+ ne kulkeutuvat anodista katodiin, jossa ne vähenevät H: ksi2.
Elektrolyysi kiinteillä oksideilla
Hyvin erilainen kuin muilla tekniikoilla, se käyttää oksideja elektrolyytteinä, jotka korkeassa lämpötilassa (600-900 ºC) toimivat anionin kuljetusalustana.2-.
Reaktiot ovat:
2H2O (g) + 4e- => 2H2(g) + 2O2-
2O2- => O2(g) + 4e-
Huomaa, että tällä kertaa ovat oksidianionit, OR2-, ne, jotka matkustavat anodiin.
Mikä on vesielektrolyysin käyttö?
Vesielektrolyysi tuottaa H2 (g) ja O2 (G). Noin 5% maailmassa tuotetusta vetykaasusta tuotetaan veden elektrolyysillä.
H2 se on vesipitoisten NaCl-liuosten elektrolyysin sivutuote. Suolan läsnäolo helpottaa elektrolyysiä lisäämällä veden sähkönjohtavuutta.
Maailmanlaajuinen reaktio on:
2NaCl + 2H2O => Cl2 + H2 + 2 NaOH: lla
Tämän reaktion valtavan tärkeyden ymmärtämiseksi mainitaan joitakin kaasumaisen tuotteen käyttötarkoituksia; koska päivän päätteeksi nämä ovat sellaisia, jotka kehittävät uusia menetelmiä veden elektrolyysin saavuttamiseksi tehokkaammin ja vihreämmin.
Kaikkein halutuimmista on toimia soluina, jotka korvaavat energisesti fossiilisten polttoaineiden käytön.
Vedyn tuotanto ja sen käyttö
-Elektrolyysissä tuotettua vetyä voidaan käyttää kemianteollisuudessa, joka toimii riippuvuusreaktioissa, hydrausprosesseissa tai pelkistävänä aineena pelkistysprosesseissa..
-Joissakin kaupallisesti merkittävissä toimissa, kuten esimerkiksi kloorivetyhapon, vetyperoksidin, hydroksyyliamiinien jne. Valmistuksessa, on olennaista. Osallistuu ammoniakin synteesiin katalyyttisellä reaktiolla typellä.
-Yhdessä hapen kanssa se tuottaa liekkejä, joiden kaloripitoisuus on korkea ja joiden lämpötilat vaihtelevat välillä 3 000 - 3 500 K. Näitä lämpötiloja voidaan käyttää metalliteollisuuden leikkauksiin ja hitseihin, synteettisten kiteiden kasvuun, kvartsin tuotantoon jne..
-Vedenkäsittely: liian korkea nitraattien pitoisuus vedessä voidaan vähentää poistamalla ne bioreaktoreissa, joissa bakteerit käyttävät vetyä energialähteenä
-Vety syntyy muovien, polyesterin ja nailonin synteesissä. Lisäksi se on osa lasin tuotantoa, mikä lisää palamista polttamisen aikana.
-Reagoi monien metallien oksidien ja kloridin kanssa, muun muassa hopea, kupari, lyijy, vismuti ja elohopea, jotta saadaan puhdasta metalliä.
-Lisäksi sitä käytetään polttoaineena liekkidetektorin kromatografisissa analyyseissä.
Debugging-menetelmänä
Natriumkloridiliuosten elektrolyysiä käytetään uima-altaan veden puhdistamiseen. Elektrolyysin aikana vetyä tuotetaan katodissa ja kloorissa (Cl2) anodissa. Tässä tapauksessa puhutaan elektrolyysistä suolaklorinaattorina.
Kloori liukenee veteen muodostaen hypokloorihappoa ja natriumhypokloriittia. Hypokloorihappo ja natriumhypokloriitti steriloivat vettä.
Koska happi
Veden elektrolyysiä käytetään myös hapen muodostamiseen kansainvälisessä avaruusasemassa, joka palvelee hapen ilmakehän ylläpitämistä asemassa.
Vetyä voidaan käyttää polttoainekennossa, energian tallennusmenetelmässä ja käyttää solussa syntyvää vettä astronauttien kulutukseen..
Kotikokeilu
Vesielektrolyysikokeita on tehty laboratorio-asteikoissa Hoffmanin volttimittareilla tai muulla kokoonpanolla, joka mahdollistaa kaikkien tarvittavien sähkökemiallisen kennon elementtien sisällyttämisen.
Kaikista mahdollisista kokoonpanoista ja laitteista yksinkertaisin voi olla suuri läpinäkyvä vesisäiliö, joka toimii soluna. Tähän lisätään myös metalli- tai sähköä johtava pinta, joka toimii elektrodeina. toinen katodille ja toinen anodille.
Tätä varten jopa molemmissa päissä teroitetut kynät, joissa on grafiittipisteitä, voivat olla hyödyllisiä. Ja lopuksi pieni akku ja jotkut kaapelit, jotka yhdistävät sen improvisoituihin elektrodeihin.
Jos sitä ei tehdä läpinäkyvässä säiliössä, kaasukuplien muodostumista ei voitu arvioida.
Kotimuuttujat
Vaikka veden elektrolyysi on aihe, joka sisältää monia mielenkiintoisia ja toiveikkaita näkökohtia niille, jotka etsivät vaihtoehtoisia energialähteitä, kotikokeilu voi olla tylsää lapsille ja muille katsojille..
Siksi voidaan muodostaa riittävä jännite H: n muodostamiseksi2 ja O2 vaihtelee tiettyjä muuttujia ja huomaa muutokset.
Ensimmäinen niistä on veden pH: n vaihtelu käyttämällä etikkaa happamaksi vettä tai Na2CO3 perustaa se hieman. On havaittava muutos havaittujen kuplien määrässä.
Lisäksi sama koe voidaan toistaa kylmällä ja kuumalla vedellä. Tällä tavoin harkitaan lämpötilan vaikutusta reaktioon.
Lopuksi, jotta tietojenkeruu olisi hieman vähemmän väritön, voit turvautua hyvin laimeaan purppurihappomehun ratkaisuun. Tämä mehu on luonnollisen alkuperän happoindikaattori.
Sen lisääminen säiliöön, jossa on esitetyt elektrodit, havaitaan, että anodissa vesi muuttuu vaaleanpunaiseksi (happo), kun taas katodissa väritys on keltainen (perus)..
viittaukset
- Wikipedia. (2018). Veden elektrolyysi. Haettu osoitteesta: en.wikipedia.org
- Chaplin M. (16. marraskuuta 2018). Veden elektrolyysi. Vesirakenne ja tiede. Haettu osoitteesta: 1.lsbu.ac.uk
- Energiatehokkuus ja uusiutuva energia. (N.D.). Vetytuotanto: elektrolyysi. Haettu osoitteesta energy.gov
- Phys.org. (14. helmikuuta 2018). Tehokas, edullinen katalysaattori veden elektrolyysille. Haettu osoitteesta phys.org
- Kemia LibreTexts. (18. kesäkuuta 2015). Veden elektrolyysi. Haettu osoitteesta: chem.libretexts.org
- Xiang C., M. Papadantonakisab K. ja S. Lewis N. (2016). Veden halkaisun elektrolyysijärjestelmien periaatteet ja toteutukset. Royal Society of Chemistry.
- Minnesotan yliopiston hallitsijat. (2018). Veden elektrolyysi 2. Minnesotan yliopisto. Haettu osoitteesta: chem.umn.edu


